Tiltrækker eller frigiver klor elektroner?
* Elektronegativitet: Klor har en høj elektronegativitet, hvilket betyder, at det har en stærk tendens til at tiltrække elektroner mod sig selv, når det danner kemiske bindinger.
* Elektronkonfiguration: Klor har syv elektroner i sin yderste skal. Det har brug for endnu en elektron for at opnå en stabil, fuld ydre skal (som de ædle gasser). Dette gør det meget reaktivt og ivrig efter at få et elektron.
Eksempler:
* I en kovalent binding med et mindre elektronegativt element (som brint i HCI) vil klor trække de delte elektroner tættere på sig selv og skabe en delvis negativ ladning på kloratomet.
* Når klor reagerer med et metal (som natrium i NaCI), får det et elektron fra metallet og danner en negativt ladet chloridion (CL⁻).
Kortfattet: Chlorens stærke elektronegativitet og elektronkonfiguration gør det til en elektronacceptor, hvilket fører til at tiltrække elektroner i kemiske reaktioner.
 Varme artikler
Varme artikler
-
 Forsker kortlægger kæmpe virusKristin Parent kortlagde strukturen af den gigantiske Samba-virus med MSUs kryo-EM-mikroskop, som er omtalt på forsiden af bladet Virus . Kredit:Michigan State University I et laboratorium v
Forsker kortlægger kæmpe virusKristin Parent kortlagde strukturen af den gigantiske Samba-virus med MSUs kryo-EM-mikroskop, som er omtalt på forsiden af bladet Virus . Kredit:Michigan State University I et laboratorium v -
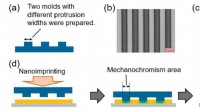 Forskning afslører kvantitative og højopløselige trykfunktioner af trykfølsomt materiale(a) Tværsnitsbillede af to siliciumforme. (b) Fotografier af en storskala siliciumform. (c) AFM billede af en smal skala silicium form. (d) Illustration til undersøgelse af rumlig opløsning ved hjælp
Forskning afslører kvantitative og højopløselige trykfunktioner af trykfølsomt materiale(a) Tværsnitsbillede af to siliciumforme. (b) Fotografier af en storskala siliciumform. (c) AFM billede af en smal skala silicium form. (d) Illustration til undersøgelse af rumlig opløsning ved hjælp -
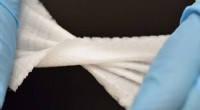 3D-trykt Biomesh minimerer brokreparationskomplikationer3D -printet Biomesh demonstrerer sin mekaniske styrke og fleksibilitet. Kredit:Baylor College of Medicine Brok er en af de mest almindelige bløde vævsskader. Brok dannes ved intra-abdominal indh
3D-trykt Biomesh minimerer brokreparationskomplikationer3D -printet Biomesh demonstrerer sin mekaniske styrke og fleksibilitet. Kredit:Baylor College of Medicine Brok er en af de mest almindelige bløde vævsskader. Brok dannes ved intra-abdominal indh -
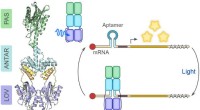 Blåt lys til RNA -kontrolFotoreceptoren PAL binder korte ribonukleinsyrer ved bestråling af blåt lys. Denne lysstyrede aktivitet kan bruges til at regulere RNA-baserede processer, såsom translation. Kredit:© Andreas Möglich/U
Blåt lys til RNA -kontrolFotoreceptoren PAL binder korte ribonukleinsyrer ved bestråling af blåt lys. Denne lysstyrede aktivitet kan bruges til at regulere RNA-baserede processer, såsom translation. Kredit:© Andreas Möglich/U
- Densitet til molaritetskonvertering
- Hvad er det maksimale antal elektroner, som orbitaler kan holde sammen?
- Sådan laver du en 3D-model af Sodium
- Hvilke fire elementer udgør hovedparten af alle livinger betyder noget?
- Uddybende spørgsmål:Hvad er borgerjournalistik?
- Misforstået stormflodstrussel kan være lige så dødelig som en tsunami


