Hvad betyder det for et atom at være elektrisk reaktivt?
Her er en sammenbrud af, hvad der gør et atom elektrisk reaktivt:
* Ufyldt ydre skal: Atomer med ufuldstændige ydre skaller af elektroner har en høj tendens til at reagere. De ønsker at vinde eller miste elektroner for at fylde deres ydre skal og nå en stabil konfiguration som den nærmeste ædle gas.
* Elektronegativitet: Dette er et mål for et atoms evne til at tiltrække elektroner i en kemisk binding. Atomer med høj elektronegativitet har en tendens til at vinde elektroner, mens atomer med lav elektronegativitet har en tendens til at miste elektroner.
* ioniseringsenergi: Dette er den energi, der kræves for at fjerne et elektron fra et atom. Atomer med lav ioniseringsenergi mister let elektroner og bliver positivt ladede ioner.
* Elektronaffinitet: Dette er ændringen i energi, når et elektron tilsættes til et neutralt atom. Atomer med høj elektronaffinitet får let elektroner og bliver negativt ladede ioner.
Eksempler:
* natrium (NA): Har kun en elektron i sin ydre skal. Det mister let denne elektron for at blive en positivt ladet Na+ -ion, som har en stabil elektronkonfiguration som Neon (NE).
* klor (Cl): Har syv elektroner i sin ydre skal. Det får let en elektron for at blive en negativt ladet klod, som har en stabil elektronkonfiguration som Argon (AR).
Derfor er et atoms elektriske reaktivitet direkte relateret til dens evne til at deltage i kemiske reaktioner ved at vinde, miste eller dele elektroner for at opnå en stabil elektronkonfiguration.
 Varme artikler
Varme artikler
-
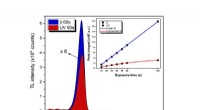 Aluminiumoxidkrystal testet som UV-strålingssensorIntensitet og temperatur. Detektering og måling af UV-eksponering i forskellige miljøer var omfanget af en undersøgelse. Kredit:Neilo Marcos Trindade og hans team Udsættelse for ultraviolet (UV) s
Aluminiumoxidkrystal testet som UV-strålingssensorIntensitet og temperatur. Detektering og måling af UV-eksponering i forskellige miljøer var omfanget af en undersøgelse. Kredit:Neilo Marcos Trindade og hans team Udsættelse for ultraviolet (UV) s -
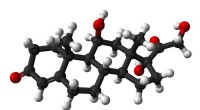 Bærbar enhed måler kortisol i svedBold-og-stik-model af cortisol (hydrocortison) molekylet. Kredit:Public Domain Hormonet kortisol stiger og falder naturligt i løbet af dagen og kan stige som reaktion på stress, men nuværende meto
Bærbar enhed måler kortisol i svedBold-og-stik-model af cortisol (hydrocortison) molekylet. Kredit:Public Domain Hormonet kortisol stiger og falder naturligt i løbet af dagen og kan stige som reaktion på stress, men nuværende meto -
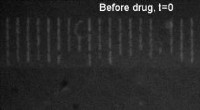 Ny teknik, hvor lægemidler får bakterier til at lyse, kan hjælpe med at bekæmpe antibiotikaresis…Lægemiddeloptagelse i bakterier før og efter. Kredit:Dr Stefano Pagliara, University of Exeter En ny teknik kan hjælpe med at reducere antibiotikaudskrivning ved at forudsige, hvilke lægemidler de
Ny teknik, hvor lægemidler får bakterier til at lyse, kan hjælpe med at bekæmpe antibiotikaresis…Lægemiddeloptagelse i bakterier før og efter. Kredit:Dr Stefano Pagliara, University of Exeter En ny teknik kan hjælpe med at reducere antibiotikaudskrivning ved at forudsige, hvilke lægemidler de -
 Katalyserer ammoniakdannelse ved lavere temperaturer med rutheniumMetallet ruthenium, understøttet med lanthanidoxyhydrider, kan effektivt katalysere syntesen af ammoniak ved en meget lavere temperatur end den traditionelle tilgang. Kredit:Tokyo Tech Nitrogen
Katalyserer ammoniakdannelse ved lavere temperaturer med rutheniumMetallet ruthenium, understøttet med lanthanidoxyhydrider, kan effektivt katalysere syntesen af ammoniak ved en meget lavere temperatur end den traditionelle tilgang. Kredit:Tokyo Tech Nitrogen
- Hvilket element har lignende kemiske egenskaber som nitrogen?
- Et ingeniørperspektiv på at bruge sølv mod mikrober
- Hvad er en datum overflade?
- Astronomer udfører en omfattende undersøgelse af den unge åbne klynge NGC 2345
- Stresspral kan få dig til at virke mindre kompetent, mindre sympatisk på arbejdet
- Forene forskelle i fortolkninger af den globale opvarmning


