Hvordan reagerer ikke -metaller med vand?
1. Ingen reaktion: De fleste ikke -metaller, som svovl, fosfor og jod, reagerer ikke med vand ved stuetemperatur.
2. Reaktioner med begrænset reaktivitet: Nogle ikke -metaller, som brom, er lidt opløselige i vand og kan reagere på en lille grad. Denne reaktion er ofte langsom og reversibel.
3. Reaktioner med ilt i vand: Nogle ikke -metaller, som klor, reagerer med vand i nærvær af opløst ilt. Denne reaktion er mere kompleks og involverer dannelse af forskellige produkter.
4. Reaktioner med syrer: Nogle ikke -metaller, som svovl og fosfor, kan reagere med syrer som salpetersyre for at danne oxider og andre forbindelser.
5. Reaktioner med baser: Nogle ikke -metaller, som klor og brom, kan reagere med baser for at danne forskellige produkter. Denne reaktion er ofte eksotermisk.
6. Reaktioner med specifikke forhold: Nogle ikke -metaller, som nitrogen og kulstof, kan reagere med vand under specifikke forhold. For eksempel kan nitrogen reagere med vand ved høje temperaturer og tryk for at danne ammoniak.
Eksempelreaktioner:
* klor med vand: CL2 + H2O -> HCL + HOCl (Hypochlorous Acid)
* svovl med salpetersyre: S + 6HNO3 -> H2SO4 + 6NO2 + 2H2O
Vigtige overvejelser:
* reaktivitet påvirkes af ikke -metalens elektronegativitet og tilstedeværelsen af andre elementer.
* reaktioner med vand kan påvirkes af faktorer som temperatur, tryk og tilstedeværelsen af katalysatorer.
* Produkterne fra disse reaktioner kan være farlige.
Generelt er reaktiviteten af ikke -metaller med vand mere nuanceret end metaller. Mens nogle reaktioner forekommer, er andre begrænsede eller kræver specifikke betingelser. Det er vigtigt at overveje den specifikke ikke -metal og reaktionsmiljøet, når man forudsiger resultatet af en reaktion.
Sidste artikelHvorfor er natriumfluor en forbindelse?
Næste artikelHvad er den grundlæggende egenskab ved en væske?
 Varme artikler
Varme artikler
-
 Ny indsigt i nanokrystalvækst i væskeGlimmer mineralet flager af i fine plader. Kredit:Wikimedia Commons Mange muslingeskaller, mineraler, og halvleder nanomaterialer er opbygget af mindre krystaller, som er samlet som brikkerne i et
Ny indsigt i nanokrystalvækst i væskeGlimmer mineralet flager af i fine plader. Kredit:Wikimedia Commons Mange muslingeskaller, mineraler, og halvleder nanomaterialer er opbygget af mindre krystaller, som er samlet som brikkerne i et -
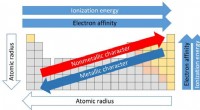 Forståelse af det periodiske system gennem linsen af de flygtige gruppe I metallerTendenser i det periodiske system. Kredit:Sandbh/Wikipedia, CC BY-SA Nyheden brød ud, at en jernbanevogn, fyldt med rent natrium, var lige afsporet og spildte dens indhold. En tv-reporter ringede
Forståelse af det periodiske system gennem linsen af de flygtige gruppe I metallerTendenser i det periodiske system. Kredit:Sandbh/Wikipedia, CC BY-SA Nyheden brød ud, at en jernbanevogn, fyldt med rent natrium, var lige afsporet og spildte dens indhold. En tv-reporter ringede -
 Forskning i havvands overfladespænding bliver international retningslinjeOverfladespænding er vandets egenskab, der gør det muligt for insekter at skumme vandoverfladen. Forskning udført af John Lienhard og Kishor Nayar for at forstå, hvordan havvandets overfladespænding æ
Forskning i havvands overfladespænding bliver international retningslinjeOverfladespænding er vandets egenskab, der gør det muligt for insekter at skumme vandoverfladen. Forskning udført af John Lienhard og Kishor Nayar for at forstå, hvordan havvandets overfladespænding æ -
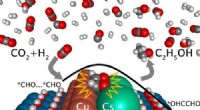 Katalysatorundersøgelse fremmer omdannelsen af kuldioxid til ethanolGrafisk abstrakt. Kredit:DOI:10.1021/jacs.1c03940 Et internationalt samarbejde mellem forskere har taget et væsentligt skridt hen imod realiseringen af en næsten grøn nul-net-kulstofteknologi, d
Katalysatorundersøgelse fremmer omdannelsen af kuldioxid til ethanolGrafisk abstrakt. Kredit:DOI:10.1021/jacs.1c03940 Et internationalt samarbejde mellem forskere har taget et væsentligt skridt hen imod realiseringen af en næsten grøn nul-net-kulstofteknologi, d
- Anmeldelse:Bogen viser, at Apollo 8 var en stor risiko for 3 astronauter
- Niagara Falls vil midlertidigt stoppe Gushing i 2019
- Fysikere finder øgede udsving i nanomagneter
- Sort enkepulsar fundet i kuglehoben NGC 6712
- Sådan beregnes gasforløb i en Pipe
- Hvad repræsenterer overførsels -RNA -baser, der svarer til DNA -gen -segmentet GCCAATGCT?


