Hvordan kan en kemisk reaktion få tasken oppustet?
1. Gasproduktion:
* bagepulver og eddike: Denne klassiske reaktion skaber kuldioxidgas. Når du blander bagepulver (natriumbicarbonat) og eddike (eddikesyre), reagerer de på dannelse af kuldioxid, vand og natriumacetat. Denne gas blæser posen op.
* gær og sukker: Gær forbruger sukker og producerer kuldioxid som et biprodukt. Dette er princippet bag brødfremstilling og nogle typer balloner.
* hydrogenperoxid og gær: Gær kan katalysere nedbrydningen af brintperoxid til vand og iltgas, hvilket forårsager inflation.
2. Endotermiske reaktioner:
* ammoniumnitrat og vand: Denne reaktion absorberer varme fra omgivelserne, hvilket får temperaturen på posen og dens indhold til at falde. Faldet i temperaturen kan få posen til at krympe, hvilket fører til en tilsyneladende inflation, når luften inde i posekontrakterne.
Vigtige overvejelser:
* reaktionshastigheder: Reaktionshastigheden bestemmer, hvor hurtigt posen oppustes. Nogle reaktioner er meget hurtige, mens andre er langsommere.
* tætning: Tasken skal forsegles tæt for at forhindre, at gassen slipper ud.
* sikkerhed: Vær altid forsigtig, når du udfører kemiske reaktioner, især dem, der involverer brandfarlige eller ætsende stoffer.
Eksempler:
* bagepulver vulkan: Et almindeligt videnskabseksperiment, hvor bagepulver og eddike reagerer for at skabe en "vulkan", der bryder ud med skum.
* balloninflation med gær: En simpel aktivitet, hvor gær forbruger sukker og producerer kuldioxid for at blæse en ballon.
* oppustelige redningsveste: Nogle oppustelige redningsveste bruger en kemisk reaktion til at blæse op, typisk udløst ved at trække en ledning eller udsætte kemikalierne for vand.
Det er vigtigt at vælge den rigtige kemiske reaktion til din specifikke anvendelse. Overvej den ønskede inflationshastighed, sikkerhed og de involverede materialer.
 Varme artikler
Varme artikler
-
 Materialeforskere viser måde at lave holdbare kunstige sener fra forbedrede hydrogelerMikroskopisk foto af det kunstige senemateriale udviklet af UCLA-materialeforskere. Forbedret til at bringe detaljer frem. Ægte skala af billedet er 1 cm i bredden. Kredit:Sidi Duan, Shuwang Wu, Mutia
Materialeforskere viser måde at lave holdbare kunstige sener fra forbedrede hydrogelerMikroskopisk foto af det kunstige senemateriale udviklet af UCLA-materialeforskere. Forbedret til at bringe detaljer frem. Ægte skala af billedet er 1 cm i bredden. Kredit:Sidi Duan, Shuwang Wu, Mutia -
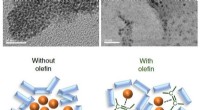 Forøgelse af kemiske reaktioner i fast tilstandØverst:Elektronmikroskopiske billeder af palladium -nanopartikler i reaktionsblandingerne. Efter 99 minutters reaktion, palladiumkatalysatoren blev fundet aggregeret og deaktiveret selv (til venstre),
Forøgelse af kemiske reaktioner i fast tilstandØverst:Elektronmikroskopiske billeder af palladium -nanopartikler i reaktionsblandingerne. Efter 99 minutters reaktion, palladiumkatalysatoren blev fundet aggregeret og deaktiveret selv (til venstre), -
 Silkeorme giver nyt spin på klæbrige molekylerTeamet har konstrueret silkeorme til at producere E-selectin, et kritisk adhæsionsmolekyle involveret i betændelse, kræft og andre sygdomsprocesser. Kredit:Takahiro Kusakabe &Jae Man Lee, Kyushu Unive
Silkeorme giver nyt spin på klæbrige molekylerTeamet har konstrueret silkeorme til at producere E-selectin, et kritisk adhæsionsmolekyle involveret i betændelse, kræft og andre sygdomsprocesser. Kredit:Takahiro Kusakabe &Jae Man Lee, Kyushu Unive -
 Håndholdte DNA-sekventører viser løfte om overvågning af mikrober under fødevareproduktionKredit:CC0 Public Domain Håndholdte enheder er velegnede til miljøovervågning under fødevareproduktion, og har nøglefordele med hensyn til brugervenlighed og ved at identificere en bred vifte af b
Håndholdte DNA-sekventører viser løfte om overvågning af mikrober under fødevareproduktionKredit:CC0 Public Domain Håndholdte enheder er velegnede til miljøovervågning under fødevareproduktion, og har nøglefordele med hensyn til brugervenlighed og ved at identificere en bred vifte af b
- Er C6H5CO2NA polar eller ikke polær?
- Forskere udvikler dual-excitation-dekodningsstrategi til termisk sensing med høj nøjagtighed
- Beregn den nødvendige joule varme for at afkøle 159 g vand ved 100oC 65oC?
- Forskere kan regne med forbedret proteomikmetode
- Kortlivede drivhusgasser forårsager århundreders stigning i havets overflade
- Forskere skaber syntetiske nanoporer lavet af DNA


