Hvorfor bruger du koncentreret salpetersyre til fremstilling af ammoniumferrisk sulfat?
1. Oxidation af jern:
* Syrens primære rolle er at oxidere jern (Fe) til dens +3 oxidationstilstand, danner jernioner (Fe³⁺). Dette er afgørende, fordi ammonium jernsulfat (NH₄) ₃fe (SO₄) ₃ indeholder jern i +3 -tilstand.
* Koncentreret svovlsyre er et stærkt oxidationsmiddel, der er i stand til at reagere med jernmetal. Denne reaktion producerer jern (III) sulfat, som er en nøglekomponent i ammoniumferrisk sulfat.
2. Reaktion med ammoniumsulfat:
* Efter oxidationen indeholder opløsningen jern (III) sulfat (Fe₂ (SO₄) ₃).
* Denne opløsning blandes derefter med ammoniumsulfat ((NH₄) ₂SO₄).
* Reaktionen mellem jern (III) sulfat og ammoniumsulfat producerer ammoniumferrisk sulfat.
Hvorfor ikke salpetersyre?
* Mens salpetersyre også er et oxidationsmiddel, er det ikke så velegnet til denne specifikke præparat:
* Salpetersyre producerer nitrogenoxider (NOX) som biprodukter, hvilket kan komplicere reaktionen og gøre oprensningen af det endelige produkt vanskeligere.
* Brugen af salpetersyre kan føre til dannelse af uønskede nitrater, hvilket kan være vanskeligt at fjerne.
Kortfattet:
* Koncentreret svovlsyre er det foretrukne reagens til fremstilling af ammoniumferrisk sulfat, fordi det effektivt oxideres jern til +3 tilstand og undgår dannelse af uønskede biprodukter.
* Salpetersyre bruges typisk ikke på grund af dens tendens til at producere NOX og nitrater, som komplicerer processen.
Sidste artikelHvordan kan en kemisk reaktion få tasken oppustet?
Næste artikelHvad er et atommolekyle?
 Varme artikler
Varme artikler
-
 Undersøgelse sporer hjernens indre funktion med ny biosensorANU-lektor Colin Jackson (til venstre) var en af de førende forskere i denne undersøgelse. Kredit:Stuart Hay, ANU Et internationalt hold af forskere har taget et vigtigt skridt i retning af at f
Undersøgelse sporer hjernens indre funktion med ny biosensorANU-lektor Colin Jackson (til venstre) var en af de førende forskere i denne undersøgelse. Kredit:Stuart Hay, ANU Et internationalt hold af forskere har taget et vigtigt skridt i retning af at f -
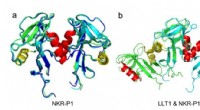 Fra atomet til naturlig dræbercelle:Historien om en uventet proteinstrukturStruktur af human NKR-P1, der viser den unikke dimeriseringsgrænseflade. Panel (a) sammenligner krystalstrukturer af NKR-P1-receptorbindende domæne-dimerer. Panel (b) viser en strukturel sammenligning
Fra atomet til naturlig dræbercelle:Historien om en uventet proteinstrukturStruktur af human NKR-P1, der viser den unikke dimeriseringsgrænseflade. Panel (a) sammenligner krystalstrukturer af NKR-P1-receptorbindende domæne-dimerer. Panel (b) viser en strukturel sammenligning -
 Ny ikke-destruktiv optisk teknik afslører strukturen af perlemorKredit:Unsplash/CC0 Public Domain De fleste kender perlemor, et iriserende biomineral også kaldet Nacre, fra knapper, smykker, instrumentindlæg og andre dekorative opblomstringer. Videnskabsmænd,
Ny ikke-destruktiv optisk teknik afslører strukturen af perlemorKredit:Unsplash/CC0 Public Domain De fleste kender perlemor, et iriserende biomineral også kaldet Nacre, fra knapper, smykker, instrumentindlæg og andre dekorative opblomstringer. Videnskabsmænd, -
 En grønnere proces til at udvinde forbindelser fra landbrugs- og madaffaldPlukkede æbler på frugthave. Kredit:Jill Wellington fra Pixabay Forskere ved University of Adelaide har identificeret en grønnere proces til udvinding af sundhedsfremmende molekyler fundet i landb
En grønnere proces til at udvinde forbindelser fra landbrugs- og madaffaldPlukkede æbler på frugthave. Kredit:Jill Wellington fra Pixabay Forskere ved University of Adelaide har identificeret en grønnere proces til udvinding af sundhedsfremmende molekyler fundet i landb
- W. M. Keck Observatory opnår første lys med nyt instrument
- I katastrofer vågner, nye computerteknikker understøtter beredskabspersonale
- Reducer, genbrug, genbrug:Hvordan genetisk modificerede fluer kan reducere affald og holde det væk …
- Hvad er effekten af en kuglerafstand på tæppet?
- Hvad er en utilstrækkelig produktion af hormoner?
- Opfandt Albert Einstein fonografen?


