Hvad er kemi bag redox -titrering?
Kemien bag redox -titrering
Redox -titrering er en kraftig analytisk teknik, der anvender overførslen af elektroner mellem en titrant og en analyt til at bestemme koncentrationen af en ukendt opløsning. Her er en sammenbrud af de vigtigste kemiske koncepter:
1. Oxidationsreduktionsreaktioner (redox):
* Oxidation: Tab af elektroner af en art.
* reduktion: Gevinst af elektroner af en art.
* redox -par: Et par kemiske arter, der er interkonvertible ved forstærkning eller tab af elektroner.
* redoxreaktioner: Reaktioner, der involverer overførsel af elektroner mellem to arter.
2. Titreringsprincipper:
* titrant: En opløsning af kendt koncentration, der blev brugt til at reagere med analytten.
* analyt: Substansen af ukendt koncentration, der analyseres.
* ækvivalenspunkt: Pointen i titreringen, hvor molen af titrant tilsat er støkiometrisk ækvivalent med molen af den tilstedeværende analyt.
* slutpunkt: Pointen i titreringen, hvor en visuel indikator signaliserer afslutningen af reaktionen.
3. Redox -titreringsmekanisme:
* Titranten indeholder en redox -aktiv art, der reagerer med analytten i en redoxreaktion.
* Reaktionen fortsætter, indtil al analytten forbruges, hvilket resulterer i en ændring i løsningens potentiale.
* Denne ændring i potentiale overvåges ved hjælp af en indikator, som kan være en farveændring, en ændring i ledningsevne eller en ændring i pH.
4. Standard elektrodepotentiale (E °):
* Et mål for en arts tendens til at få elektroner (reduceres).
* Bruges til at forudsige gennemførligheden og retningen af redoxreaktioner.
5. NERNST Ligning:
* Beskriver forholdet mellem elektrodepotentialet, standardelektrodepotentialet og koncentrationen af de reagerende arter.
* Tillader os at beregne potentialet i løsningen på forskellige punkter under titreringen.
6. Nøgleovervejelser:
* Valg af titrant: Titranten skal være et stærkt oxiderende eller reduktionsmiddel, der reagerer hurtigt og støkiometrisk med analytten.
* Indikatorudvælgelse: Indikatoren skal være et passende redoxpar, der ændrer farve nær ækvivalenspunktet.
* Miljøforhold: Faktorer som temperatur og pH kan påvirke reaktionshastigheden og potentialet i opløsningen.
Eksempler på redox -titreringer:
* permanganattitreringer: Under anvendelse af kaliumpermanganat (KMNO4) som et stærkt oxidationsmiddel til at bestemme koncentrationen af reduktionsmidler som jern (II) -ioner.
* jod-thiosulfattitreringer: Brug af jod (I2) som titrant til at bestemme koncentrationen af reduktionsmidler som vitamin C.
Fordele ved redox -titrering:
* Høj nøjagtighed og præcision.
* Alsidig teknik, der gælder for en lang række analyser.
* Relativt billig og let at udføre.
Redox -titrering er en grundlæggende teknik, der bruges på forskellige områder, herunder kemi, miljøovervågning og kvalitetskontrol, til at analysere prøver og bestemme koncentrationen af vigtige komponenter.
 Varme artikler
Varme artikler
-
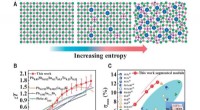 Højentropi-stabiliserede chalcogenider med høj termoelektrisk ydeevneForbedring af ydeevnen af termoelektriske materialer og moduler gennem entropiteknik. (A) Diagram over gitterforvrængning med stigende entropi. Den lyserøde, rød, grøn, blå, og lilla kugler repræsen
Højentropi-stabiliserede chalcogenider med høj termoelektrisk ydeevneForbedring af ydeevnen af termoelektriske materialer og moduler gennem entropiteknik. (A) Diagram over gitterforvrængning med stigende entropi. Den lyserøde, rød, grøn, blå, og lilla kugler repræsen -
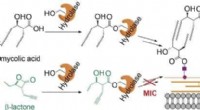 Antibakteriel beta-lacton infiltrerer mykomembranbiosyntesen og dræber tuberkulosepatogenKredit:Wiley Tuberkulose er en af de mest udbredte livstruende infektionssygdomme. Ikke alene gør antibiotikaresistens behandling stadig sværere, men bakteriernes relativt uigennemtrængelige myk
Antibakteriel beta-lacton infiltrerer mykomembranbiosyntesen og dræber tuberkulosepatogenKredit:Wiley Tuberkulose er en af de mest udbredte livstruende infektionssygdomme. Ikke alene gør antibiotikaresistens behandling stadig sværere, men bakteriernes relativt uigennemtrængelige myk -
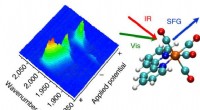 Laserteknik kan åbne døren til mere effektive rene brændstofferKredit:University of Liverpool Forskning fra University of Liverpool kan hjælpe videnskabsmænd med at frigøre det fulde potentiale af nye rene energiteknologier. At finde bæredygtige måder at ers
Laserteknik kan åbne døren til mere effektive rene brændstofferKredit:University of Liverpool Forskning fra University of Liverpool kan hjælpe videnskabsmænd med at frigøre det fulde potentiale af nye rene energiteknologier. At finde bæredygtige måder at ers -
 Pentacenderivat har 100 gange mere lysholdbarhed end konventionelle produkterLysustabilitet er en vigtig faktor, der forhindrer organiske halvledere i at blive implementeret. Forskere fra Osaka Metropolitan University demonstrerede, at den ultrahurtige intersystem-krydsning af
Pentacenderivat har 100 gange mere lysholdbarhed end konventionelle produkterLysustabilitet er en vigtig faktor, der forhindrer organiske halvledere i at blive implementeret. Forskere fra Osaka Metropolitan University demonstrerede, at den ultrahurtige intersystem-krydsning af
- Mineralmagi? Almindelig mineral, der er i stand til at danne og bryde bindinger
- Er Australien i grebet af en ungdomskriminalitetskrise? Dette er, hvad data siger
- Hvilken cyklus producerer mest NADH?
- Hvad er den vigtigste atmosfæriske gas på Mars?
- Hvilken udvinding af salt fra havvand?
- To tredjedele af jordens land er på vej til at miste vand, når klimaet opvarmes


