Hvordan anvendes valenselektroner af et atom til klassificering?
1. Kemiske egenskaber:
* reaktivitet: Valenselektroner er de yderste elektroner og er involveret i kemisk binding. Atomer med en fuld ydre skal (8 valenselektroner) er stabile og ureaktive (ædelgasser). Atomer med færre valenselektroner har en tendens til at være reaktive, stræber efter at vinde, miste eller dele elektroner for at opnå en stabil konfiguration.
* limningstype: Antallet af valenselektroner dikterer den type bindinger, et atom kan danne. For eksempel har metaller med 1-3 valenselektroner en tendens til at danne ioniske bindinger ved at miste elektroner, mens ikke-metaller med 5-7 valenselektroner har en tendens til at danne kovalente bindinger ved at dele elektroner.
* Oxidation siger: Valenselektroner bestemmer oxidationsstaterne, som et atom kan antage i forbindelser. Dette indikerer antallet af elektroner, som et atom har opnået, mistet eller delt under bindingsdannelse.
2. Periodisk tabelklassificering:
* grupper (kolonner): Elementer inden for den samme gruppe (lodret kolonne) i den periodiske tabel har det samme antal valenselektroner. Dette forklarer, hvorfor elementer i den samme gruppe deler lignende kemiske egenskaber.
* perioder (rækker): Bevægelse af en periode stiger antallet af valenselektroner fra venstre mod højre. Dette svarer til påfyldningen af den yderste elektronskal, der påvirker atomets egenskaber.
Kortfattet:
Antallet og konfigurationen af valenselektroner giver nøgleindsigt i et atoms:
* reaktivitet: hvor let det danner obligationer
* limningstype: ionisk, kovalent eller metallisk
* Oxidationstilstand: Dets potentiale for elektronforstærkning eller tab
* Periodisk tabelposition: dens gruppe og periode
Ved at analysere valenselektronstrukturen kan kemikere forstå og forudsige adfærd af elementer og deres interaktioner til dannelse af forbindelser.
 Varme artikler
Varme artikler
-
 At dreje det periodiske system gennem 180 grader for et nyt perspektivKredit:University of Nottingham Kunne vende det periodiske system på hovedet gøre nogle vigtige aspekter lettere at forstå og begejstre flere for at studere kemi? Dette spørgsmål stilles i en art
At dreje det periodiske system gennem 180 grader for et nyt perspektivKredit:University of Nottingham Kunne vende det periodiske system på hovedet gøre nogle vigtige aspekter lettere at forstå og begejstre flere for at studere kemi? Dette spørgsmål stilles i en art -
 Kemisk billeddannelse bruges til at hjælpe med diagnosticering af tyktarmskræftFourier-transform infrarød (FTIR) spektroskopisk billeddannelse af tyktarmsvæv. Kredit:Sergei Kazarian Forskere har udviklet en metode til kemisk billeddannelse, som identificerer tyktarmskræft me
Kemisk billeddannelse bruges til at hjælpe med diagnosticering af tyktarmskræftFourier-transform infrarød (FTIR) spektroskopisk billeddannelse af tyktarmsvæv. Kredit:Sergei Kazarian Forskere har udviklet en metode til kemisk billeddannelse, som identificerer tyktarmskræft me -
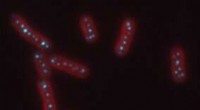 Forståelse af membranen i membranløse organellerPå billedet ses et fluorescensbillede af cyanobakterier, i rødt, med carboxysomer, i cyan. Kredit:Biteen og Vecchiarelli Labs Organeller i celler er små motorer, der indkapsler processer, der till
Forståelse af membranen i membranløse organellerPå billedet ses et fluorescensbillede af cyanobakterier, i rødt, med carboxysomer, i cyan. Kredit:Biteen og Vecchiarelli Labs Organeller i celler er små motorer, der indkapsler processer, der till -
 Forskere frigiver det første kemiske kort over farvestoffer fra det historiske farvebibliotekPrøver fra Max A. Weavers farvestofbibliotek. Kredit:NC State University Forskere fra North Carolina State University har frigivet det første kemiske kort over farvestoffer fra Max A. Weaver Dye L
Forskere frigiver det første kemiske kort over farvestoffer fra det historiske farvebibliotekPrøver fra Max A. Weavers farvestofbibliotek. Kredit:NC State University Forskere fra North Carolina State University har frigivet det første kemiske kort over farvestoffer fra Max A. Weaver Dye L


