Hvor mange liter C2H2 skal produceres fra 80 gram H2O?
1. Afbalanceret kemisk ligning
Den reaktion, du beskriver, er reaktionen af calciumcarbid (CAC₂) med vand (H₂O) til at producere acetylen (C₂H₂) og calciumhydroxid (Ca (OH) ₂):
CAC₂ (S) + 2 H₂O (L) → C₂H₂ (G) + CA (OH) ₂ (AQ)
2. Støkiometri
* molmasse: Beregn de molære masser af de involverede arter:
* H₂O:18.015 g/mol
* C₂H₂:26,04 g/mol
* molberegning: Konverter den givne masse vand (80 g) til mol:
* Mol H₂O =(80 g) / (18,015 g / mol) =4,44 mol
* molforhold: Brug molforholdet fra den afbalancerede ligning til at finde mol på C₂H₂:
* 2 mol H₂O:1 mol c₂h₂
* Mol C₂H₂ =(4,44 mol H₂O) * (1 mol C₂H₂ / 2 mol H₂O) =2,22 mol C₂H₂
* Beregning af volumen: Vi kan bruge den ideelle gaslov (PV =NRT) til at konvertere mol C₂H₂ til volumen. Vi bliver nødt til at antage standardtemperatur og tryk (STP):
* STP:T =273,15 K, P =1 ATM
* R (Ideal Gas Constant) =0,0821 L · ATM/(Mol · K)
* Volumen C₂H₂ =(NRT) / P =(2,22 mol * 0,0821 L · ATM / (Mol · K) * 273,15 K) / 1 ATM = 49,9 L
Derfor skal ca. 49,9 liter c₂h₂ produceres fra 80 gram H₂o.
Sidste artikelFind massen i gram på 1,54 mol H2O?
Næste artikelHvorfor oxidationstilstanden for ilt er -2 i kulilte?
 Varme artikler
Varme artikler
-
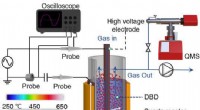 Ikke-termisk plasma-promoveret CO2-hydrogenering i nærværelse af legeringskatalysatorerFigur 1. Kuldioxidgenanvendelse - innovativt plasmakatalysekoncept. Dielektrisk barriereudladningsreaktor med fluidiseret leje blev brugt til CO2-hydrogenering over Pd2 Ga/SiO2 . Kredit:Journal of the
Ikke-termisk plasma-promoveret CO2-hydrogenering i nærværelse af legeringskatalysatorerFigur 1. Kuldioxidgenanvendelse - innovativt plasmakatalysekoncept. Dielektrisk barriereudladningsreaktor med fluidiseret leje blev brugt til CO2-hydrogenering over Pd2 Ga/SiO2 . Kredit:Journal of the -
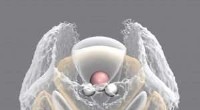 At skubbe væsker til deres grænser med næste generations materialesimuleringsmetoderEn illustration, der viser, hvordan vandmolekyler er arrangeret i væsken omkring et centralt referencemolekyle. De hvide områder viser den stærkt retningsbestemte organisering af vandtætheden i den fø
At skubbe væsker til deres grænser med næste generations materialesimuleringsmetoderEn illustration, der viser, hvordan vandmolekyler er arrangeret i væsken omkring et centralt referencemolekyle. De hvide områder viser den stærkt retningsbestemte organisering af vandtætheden i den fø -
 Polymerforskere opdager vej til bæredygtige og bionedbrydelige polyestereOpsætningen af photoredox -polymerisationen i handskerummet med en kold fælde, bestrålet af det blå LED -lys. Kredit:Virginia Tech Der er en god chance for, at du har rørt ved noget, der er lave
Polymerforskere opdager vej til bæredygtige og bionedbrydelige polyestereOpsætningen af photoredox -polymerisationen i handskerummet med en kold fælde, bestrålet af det blå LED -lys. Kredit:Virginia Tech Der er en god chance for, at du har rørt ved noget, der er lave -
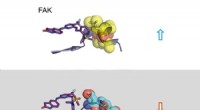 Når aktivt stof og målprotein omfavner hinandenØverste del:Lang opholdstid. En inhibitor (til venstre:stick -model) binder sig til signalmolekylet FAK (til højre:en del af FAK -proteinet afbildet som calottemodel med kugler). Strukturændringen af
Når aktivt stof og målprotein omfavner hinandenØverste del:Lang opholdstid. En inhibitor (til venstre:stick -model) binder sig til signalmolekylet FAK (til højre:en del af FAK -proteinet afbildet som calottemodel med kugler). Strukturændringen af
- Global opvarmning:Hvad hvis vi ikke gør noget?
- Hvordan relaterer en lavalampe til mantelkonvention og pladetektonik?
- Hubble skubbede ud over grænserne for at se klumper af nye stjerner i en fjern galakse
- Amatørinvestorer formår ikke at diversificere og er bedre stillet ved at vælge aktier tilfældigt
- Forholdet mellem gensidighed mellem en svamp og et træ <p> <p> På det mest basale niveau er gensid…
- Er den store Rift Valley en flod?


