Hvad illustrerer eksistensen af cu2oand cuo?
1. Variabel oxidation siger:
* Kobber kan som mange overgangsmetaller eksistere i flere oxidationstilstande. I Cu₂o har kobber en oxidationstilstand på +1, mens den i CUO har en oxidationstilstand på +2. Dette demonstrerer evnen til overgangsmetaller til at danne forbindelser med forskellige oxidationstilstande, hvilket fører til forskellige kemiske egenskaber.
2. Forskellig kemisk binding:
* De forskellige oxidationstilstande af kobber fører til forskellige typer kemisk binding. Cu₂o er en kovalent forbindelse med en mere ionisk karakter, mens Cuo har en mere ionisk karakter. Denne forskel i binding påvirker deres fysiske og kemiske egenskaber, såsom smeltepunkter, opløselighed og reaktivitet.
3. Indflydelse af ilt:
* Tilstedeværelsen af ilt spiller en afgørende rolle i bestemmelsen af kobberens oxidationstilstand og den resulterende forbindelse. I Cu₂o mister hvert kobberatom et elektron, mens hvert kobberatom i CuO mister to elektroner. Dette viser, hvordan ilt, et stærkt oxidationsmiddel, kan påvirke oxidationstilstanden for andre elementer.
4. Kemisk ligevægt:
* Cu₂o og Cuo kan interkonverteres under specifikke forhold. For eksempel kan Cu₂o oxideres til CuO i nærvær af overskydende ilt. Denne interkonversion fremhæver den dynamiske karakter af kemiske reaktioner og begrebet ligevægt.
5. Anvendelser i kemi:
* Både Cu₂o og Cuo har forskellige applikationer inden for forskellige felter. Cu₂o bruges i antifoulingmaling, halvledere og katalysatorer, mens Cuo bruges i keramik, pigmenter og batterier. Disse applikationer viser den praktiske betydning af at forstå de forskellige former for kobberoxider.
Sammenfattende illustrerer eksistensen af Cu₂o og CuO begreberne med variable oxidationstilstande, forskellige kemiske binding, påvirkning af ilt, kemisk ligevægt og de praktiske anvendelser af forskellige kemiske forbindelser.
 Varme artikler
Varme artikler
-
 Forskere fuldfører den første britiske undersøgelse af syntetiske kemikalier fundet i fødevarerKredit:Pixabay/CC0 Public Domain Den første omfattende vurdering af almindelige syntetiske kemikalier fundet i britiske fødevarer er blevet gennemført af forskere ved University of Birmingham. I u
Forskere fuldfører den første britiske undersøgelse af syntetiske kemikalier fundet i fødevarerKredit:Pixabay/CC0 Public Domain Den første omfattende vurdering af almindelige syntetiske kemikalier fundet i britiske fødevarer er blevet gennemført af forskere ved University of Birmingham. I u -
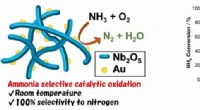 Gennembrud inden for luftrensning med en katalysator, der virker ved stuetemperatur(venstre) Forenklet skematisk oversigt over guldnanopartikler fastgjort til en ramme af nioboxid. (højre) Konverteringseffektivitet af filter med og uden guld, plus selektivitet til omdannelse til nit
Gennembrud inden for luftrensning med en katalysator, der virker ved stuetemperatur(venstre) Forenklet skematisk oversigt over guldnanopartikler fastgjort til en ramme af nioboxid. (højre) Konverteringseffektivitet af filter med og uden guld, plus selektivitet til omdannelse til nit -
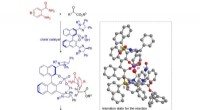 Ny metode til asymmetrisk N, N-acetalsyntese lover fremskridt inden for lægemiddeludviklingKredit:Nagoya Institute of Technology Mange af vores lægemidler og andre bioaktive lægemidler er baseret på kemiske strukturer kaldet enantiomerer - molekyler, der er spejlbilleder af hinanden og
Ny metode til asymmetrisk N, N-acetalsyntese lover fremskridt inden for lægemiddeludviklingKredit:Nagoya Institute of Technology Mange af vores lægemidler og andre bioaktive lægemidler er baseret på kemiske strukturer kaldet enantiomerer - molekyler, der er spejlbilleder af hinanden og -
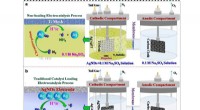 Nyt elektrokatalysesystem realiserer omgivende ammoniakelektrosynteseSkematisk illustration af en. den ikke-belastende NRR-elektrokatalyseproces og b. den traditionelle elektrokatalyseproces, der belaster katalysatoren. Kredit:LI Wenyi Det er almindeligt kendt, at
Nyt elektrokatalysesystem realiserer omgivende ammoniakelektrosynteseSkematisk illustration af en. den ikke-belastende NRR-elektrokatalyseproces og b. den traditionelle elektrokatalyseproces, der belaster katalysatoren. Kredit:LI Wenyi Det er almindeligt kendt, at
- Pinterest for at dirigere vaccinerelaterede søgninger til sundhedsorganisationer
- Facebook er ikke bekendt med noget misbrug af data fra telefonproducenter
- NASAs solsejlsteknologi består en afgørende test for implementering
- Spanien sender hjælp til at bekæmpe Portugals skovbrande
- Hvornår forbruger køleskabet mere energi?
- Påvirker jordens rotation toiletter og baseballspil?


