Hvordan finder du den molære masse af en forbindelse ved hjælp af periodisk tabel?
1. Identificer elementerne og deres underskrifter
* Se på den kemiske formel for forbindelsen. Lad os for eksempel overveje vand (H₂O).
* Du har brint (H) og ilt (O).
* Underskriften "2" efter brint betyder, at der er to hydrogenatomer i hvert vandmolekyle.
2. Se atommasser på den periodiske tabel
* Find hvert element på den periodiske tabel.
* Bemærk atommassen for hvert element. Atommasser vises normalt under elementets symbol. For eksempel:
* Hydrogen (H):1,01 g/mol
* Oxygen (O):16,00 g/mol
3. Multiplicer atommasse efter subskript
* For hvert element skal du multiplicere sin atommasse med dets underskrift i den kemiske formel.
* Hydrogen (H):1,01 g/mol * 2 =2,02 g/mol
* Oxygen (O):16,00 g/mol * 1 =16,00 g/mol
4. Tilføj masserne sammen
* Tilføj resultaterne fra trin 3 for at finde den molære masse af forbindelsen.
* Molmasse vand (H₂O):2,02 g/mol + 16,00 g/mol =18,02 g/mol
Eksempel:Find den molære masse af calciumchlorid (cacl₂)
1. elementer:calcium (CA) og klor (CL)
2. atommasser:
* Calcium (CA):40,08 g/mol
* Klor (CL):35,45 g/mol
3. gangede masser:
* Calcium (CA):40,08 g/mol * 1 =40,08 g/mol
* Klor (CL):35,45 g/mol * 2 =70,90 g/mol
4. molmasse:40,08 g/mol + 70,90 g/mol =110,98 g/mol
Nøglepunkter:
* enheder: Molmasse udtrykkes i gram pr. Mol (g/mol).
* Betydelige tal: Vær opmærksom på antallet af betydelige tal i de atommasser, du bruger. Rund dit endelige svar korrekt.
* Praksis: Jo mere du praktiserer, jo lettere bliver det at beregne molmasse.
 Varme artikler
Varme artikler
-
 Composite metal foam overgår aluminium til brug i flyvingerKredit:CC0 Public Domain De forreste kanter på flyvinger skal opfylde et meget krævende sæt egenskaber. Ny forskning viser, at en kombination af stålkompositmetalskum (CMF) og epoxyharpiks har mer
Composite metal foam overgår aluminium til brug i flyvingerKredit:CC0 Public Domain De forreste kanter på flyvinger skal opfylde et meget krævende sæt egenskaber. Ny forskning viser, at en kombination af stålkompositmetalskum (CMF) og epoxyharpiks har mer -
 Se, hvordan en kovalent polymer udvikler sig ved hjælp af et scanningstunnelmikroskopUorden-til-orden overgang. Kredit:Nature (2022). DOI:10.1038/s41586-022-04409-6 Et team af forskere fra KU Leuven, University of Aveiro, OLYMAT, University of the Basque Country UPV/EHU og Ikerbasq
Se, hvordan en kovalent polymer udvikler sig ved hjælp af et scanningstunnelmikroskopUorden-til-orden overgang. Kredit:Nature (2022). DOI:10.1038/s41586-022-04409-6 Et team af forskere fra KU Leuven, University of Aveiro, OLYMAT, University of the Basque Country UPV/EHU og Ikerbasq -
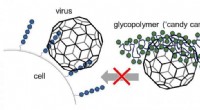 Kunstige slikstokke til at blokere viraDe kunstigt fremstillede glycomimetika (grønne) binder sig til viras bindingssteder, som vira normalt bruger til at binde til sukkerarter (blå) på celleoverfladen. Kredit:L. Hartmann, M. Schelhaas
Kunstige slikstokke til at blokere viraDe kunstigt fremstillede glycomimetika (grønne) binder sig til viras bindingssteder, som vira normalt bruger til at binde til sukkerarter (blå) på celleoverfladen. Kredit:L. Hartmann, M. Schelhaas -
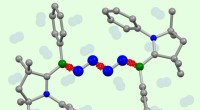 Inert nitrogen tvunget til at reagere med sig selvFor første gang, to molekyler af atmosfærisk nitrogen (blå, midten) er koblet direkte til hinanden i forskning af kemikere fra Würzburg og Frankfurt. Kredit:Dr. Rian Dewhurst / Dr. Marc-André Légaré
Inert nitrogen tvunget til at reagere med sig selvFor første gang, to molekyler af atmosfærisk nitrogen (blå, midten) er koblet direkte til hinanden i forskning af kemikere fra Würzburg og Frankfurt. Kredit:Dr. Rian Dewhurst / Dr. Marc-André Légaré
- Hvordan man identificerer ledninger på en elektrisk Pole
- Undersøisk vulkanisme kan forklare middelalderens mørkeår
- Heksekontinenter rører ikke ækvator?
- Buffers rolle i celler
- Økoaktivistiske angreb på museumskunst beder os om at finde ud af, hvad vi værdsætter
- Duften, der kunne redde Californiens avocadoer


