Kan ethanesyre udføre elektricitet i smeltet tilstand?
* ioniske forbindelser: Elektricitet udføres af bevægelsen af ladede partikler (ioner). Ioniske forbindelser, som natriumchlorid (NaCl), dissocieres i ioner, når de er smeltet, hvilket giver mulighed for strømstrøm.
* kovalente forbindelser: Ethansyre er en kovalent forbindelse. Kovalente forbindelser deler elektroner snarere end at overføre dem fuldstændigt som ioniske forbindelser. I de smeltede tilstand forbliver ethansyre -molekyler intakte og bryder ikke ned i frie ioner.
* svag syreadfærd: Mens ethansyre er en syre, er det en svag syre. Dette betyder, at det kun delvist ioniserer i opløsningen. Selv i opløsningen er koncentrationen af ioner relativt lav, hvilket begrænser dens ledningsevne.
I resuméet på grund af dens kovalente natur og svage sure egenskaber udgør ethanesyre ikke en betydelig mængde frie ioner i den smeltede tilstand, hvilket gør det til en dårlig leder af elektricitet.
 Varme artikler
Varme artikler
-
 Gør trækonstruktionsmaterialer brandsikre med en miljøvenlig belægningBelagt træ (venstre) kan modstå flammer, hvilket begrænser brandskader, i modsætning til bart træ (højre). Kredit:Ethan Iverson Ødelæggende boligbrande og skovbrande tager en frygtelig vejafgift i
Gør trækonstruktionsmaterialer brandsikre med en miljøvenlig belægningBelagt træ (venstre) kan modstå flammer, hvilket begrænser brandskader, i modsætning til bart træ (højre). Kredit:Ethan Iverson Ødelæggende boligbrande og skovbrande tager en frygtelig vejafgift i -
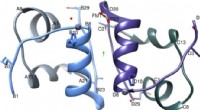 Ny forskning kan føre til flere behandlingsmuligheder for diabetespatienterIGlu-dimer med den to-foldede akse (grøn pil), A-kæden er farvet lysegrå, B-kæde i lyseblå, C-kæde i mørkegrå og D-kæde i lilla. Figur oprettet ved hjælp af Chimera v1.8.1 cgl.ucsf.edu/chimera/. Kredi
Ny forskning kan føre til flere behandlingsmuligheder for diabetespatienterIGlu-dimer med den to-foldede akse (grøn pil), A-kæden er farvet lysegrå, B-kæde i lyseblå, C-kæde i mørkegrå og D-kæde i lilla. Figur oprettet ved hjælp af Chimera v1.8.1 cgl.ucsf.edu/chimera/. Kredi -
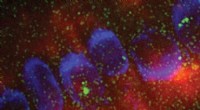 Forskning afslører første bevis på RNA-udløst faseadskillelseKredit:John Innes Center Et grundlæggende spørgsmål i biologi er, hvordan celler orkestrerer kemiske reaktioner i tid og rum. Membranløse organeller er centrum for mange af disse kemiske reaktion
Forskning afslører første bevis på RNA-udløst faseadskillelseKredit:John Innes Center Et grundlæggende spørgsmål i biologi er, hvordan celler orkestrerer kemiske reaktioner i tid og rum. Membranløse organeller er centrum for mange af disse kemiske reaktion -
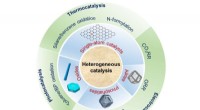 Ny anmeldelse fremhæver innovative katalysatorer:Design og anvendelseNanokatalyse spiller en afgørende rolle i den kemiske industri. Men nanokatalyse står nu over for en stor udfordring og kræver en stor revolution for at opfylde behovene i et bæredygtigt samfund. Med
Ny anmeldelse fremhæver innovative katalysatorer:Design og anvendelseNanokatalyse spiller en afgørende rolle i den kemiske industri. Men nanokatalyse står nu over for en stor udfordring og kræver en stor revolution for at opfylde behovene i et bæredygtigt samfund. Med
- Domstolenes AT &T-Time Warner-kendelse er klart forkert:USA's regering
- EPA -afgørelse snart om kemiske forbindelser knyttet til sundhedsrisici
- Hvordan flytter afgifter i et kredsløb?
- Nanotråde udviser kæmpe piezoelektricitet
- Hvilken er lettere - helium eller brint?
- Kina indfører udgangsforbud for mindreårige i forbindelse med spilindgreb


