Er molen af opløsningen lig med opløst plusopløsning?
* mol er et mål for mængden af stof. En mol repræsenterer 6,022 x 10^23 partikler (atomer, molekyler, ioner osv.).
* Løsninger består af et opløst stof opløst i et opløsningsmiddel. Opløsningen er det stof, der opløses, og opløsningsmidlet er stoffet, der udfører opløsningen (normalt vand).
* De samlede mol i en opløsning er ikke blot summen af molen af opløst stof og opløsningsmiddel.
Her er en klarere forklaring:
1. mol opløst Du kan beregne molen af opløst stof ved at dele massen af opløsningen med dens molære masse.
2. mol opløsningsmiddel: Du kan beregne molen på opløsningsmiddel på lignende måde.
3. samlede mol i opløsning: De samlede mol i opløsningen er summen af molen af opløst stof og molens opløsningsmiddel.
Eksempel:
Forestil dig, at du har en opløsning med 1 mol sukker (opløst) opløst i 10 mol vand (opløsningsmiddel).
* mol opløst stof: 1 mol
* mol opløsningsmiddel: 10 mol
* samlede mol i opløsning: 11 mol (ikke 1 mol + 10 mol)
Key Takeaway: Du kan ikke direkte tilføje molen af opløst stof og opløsningsmiddel for at få de samlede mol i en opløsning. Du skal overveje de individuelle mol for hver komponent.
Sidste artikelHvad bruges en muldvarp i kemi som?
Næste artikelHvad er den kemiske struktur af titanium diixde?
 Varme artikler
Varme artikler
-
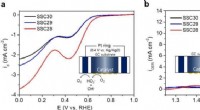 Forskere udvikler højtydende perovskitoxidkatalysatorer ved hjælp af metaloxidmaterialer med sen o…Figur 2. (a) ORR og (b) OER-aktiviteter for Sm 0,5 Sr 0,5 CoO 3−δ (δ =0,0, 0,1, og 0,2) i O 2 -mættet 0,1 M KOH ved en scanningshastighed på 10 mV s–1 og en rotationshastighed på 1600 rpm. Kre
Forskere udvikler højtydende perovskitoxidkatalysatorer ved hjælp af metaloxidmaterialer med sen o…Figur 2. (a) ORR og (b) OER-aktiviteter for Sm 0,5 Sr 0,5 CoO 3−δ (δ =0,0, 0,1, og 0,2) i O 2 -mættet 0,1 M KOH ved en scanningshastighed på 10 mV s–1 og en rotationshastighed på 1600 rpm. Kre -
 Forskere udvikler miljøvenlige, 4-i-1 katalysatorKatalysatorer som denne nye udviklet på Brown University kan muligvis hjælpe med at gøre industriel kemi mere bæredygtig. Kredit:Sun Lab / Seto Lab / Brown University Brown University-forskere har
Forskere udvikler miljøvenlige, 4-i-1 katalysatorKatalysatorer som denne nye udviklet på Brown University kan muligvis hjælpe med at gøre industriel kemi mere bæredygtig. Kredit:Sun Lab / Seto Lab / Brown University Brown University-forskere har -
 Ny eksperimentel strategi belyser kompleks krystalstrukturForskere ved universiteterne i Warwick og Cardiff har brugt en kombineret pulver XRD, solid-state NMR og beregningsmetode til at bestemme strukturen af 3, 5-bis-O-decanoyl-2-deoxyguanosin. En kombi
Ny eksperimentel strategi belyser kompleks krystalstrukturForskere ved universiteterne i Warwick og Cardiff har brugt en kombineret pulver XRD, solid-state NMR og beregningsmetode til at bestemme strukturen af 3, 5-bis-O-decanoyl-2-deoxyguanosin. En kombi -
 Startup fremmer kulstof-nul brændstoffer gennem UConn-partnerskabMattershift CEO, Rob McGinnis (forrest) og UConn lektor i kemisk og biomedicinsk teknik, Jeff McCutcheon. Kredit:Sean Flynn/UConn Da Rob McGinnis havde brug for et veludstyret laboratorium til sin
Startup fremmer kulstof-nul brændstoffer gennem UConn-partnerskabMattershift CEO, Rob McGinnis (forrest) og UConn lektor i kemisk og biomedicinsk teknik, Jeff McCutcheon. Kredit:Sean Flynn/UConn Da Rob McGinnis havde brug for et veludstyret laboratorium til sin
- Hvad er en almindelig kilde til stråling Jorden?
- Vandafsaltning sætter farten op
- Det er 75 år siden Hiroshima, alligevel består truslen om atomkrig
- Mobile MIT Robot Can 3D-print hele bygningsstrukturen i timer
- Hvilken planet udsender eller reflekterer lys?
- Forskning om børns sundhedsrisici i tvivl om EPA-midler


