Hvorfor kombineres kobber og klor sammen?
* Elektronegativitet: Elektronegativitet er målet for et atoms evne til at tiltrække elektroner mod sig selv i en kemisk binding. Klor er meget elektronegativ (3.16), hvilket betyder, at det stærkt tiltrækker elektroner. Kobber er på den anden side mindre elektronegativ (1,90).
* ionisk bindingsdannelse: Når kobber og klor samles, får chlorens stærke træk på elektroner det til at "stjæle" et elektron fra kobber. Dette skaber en positivt ladet kobberion (Cu+) og en negativt ladet chloridion (Cl-). Disse modsatte afgifter tiltrækker hinanden stærkt og danner en ionisk binding .
* Forbindelsesdannelse: Den elektrostatiske tiltrækning mellem kobber- og chloridioner resulterer i dannelsen af en forbindelse kaldet kobber (I) chlorid (Cucl) . Formlen afspejler forholdet mellem kobber og chloridioner, der er nødvendige for at afbalancere ladningerne (1:1).
Kortfattet: Kobber og klor kombineres på grund af den stærke elektrostatiske tiltrækning mellem den positivt ladede kobberion og den negativt ladede chloridion. Denne attraktion opstår fra forskellen i deres elektronegativiteter, hvilket fører til dannelse af en ionisk forbindelse.
Sidste artikelKlassificer gelé Er det en solid eller væske?
Næste artikelHvad er ladningen af phenylgruppen i phenol?
 Varme artikler
Varme artikler
-
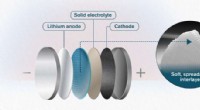 Et smørbart mellemlag kunne gøre solid state-batterier mere stabileSolid state-batterier er af stor interesse for elbilindustrien. Forskere ved Chalmers Tekniske Universitet, Sverige, og Xian Jiaotong University, Kina præsenterer nu en ny måde at bringe dette lovende
Et smørbart mellemlag kunne gøre solid state-batterier mere stabileSolid state-batterier er af stor interesse for elbilindustrien. Forskere ved Chalmers Tekniske Universitet, Sverige, og Xian Jiaotong University, Kina præsenterer nu en ny måde at bringe dette lovende -
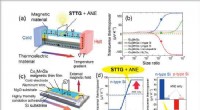 Demonstration af ukonventionel tværgående termoelektrisk generationFigur. (a) Skematisk diagram, der viser begrebet Seebeck-drevet tværgående termoelektrisk generation (STTG). Ladestrømmen forårsaget af Seebeck -effekten i det termoelektriske materiale genererer en s
Demonstration af ukonventionel tværgående termoelektrisk generationFigur. (a) Skematisk diagram, der viser begrebet Seebeck-drevet tværgående termoelektrisk generation (STTG). Ladestrømmen forårsaget af Seebeck -effekten i det termoelektriske materiale genererer en s -
 Smagsligheden mellem fødevarer kan sammenlignes ved hjælp af elektroencefalografiKredit:Pixabay/CC0 Public Domain Marina Domracheva og Sofya Kulikova, forskere fra HSE Universitets campus i Perm, har opdaget en ny tilgang til at analysere den opfattede lighed mellem fødevarer,
Smagsligheden mellem fødevarer kan sammenlignes ved hjælp af elektroencefalografiKredit:Pixabay/CC0 Public Domain Marina Domracheva og Sofya Kulikova, forskere fra HSE Universitets campus i Perm, har opdaget en ny tilgang til at analysere den opfattede lighed mellem fødevarer, -
 Opdagelse af naturligt chirale overflader til sikrere lægemidlerDe to ikke-overlejrede spejlbilleder af en chiral metaloverflade på atomskala. Kredit:Professor Andrew Gellman I 1960erne, det beroligende middel thalidomid var meget populært som et af de eneste
Opdagelse af naturligt chirale overflader til sikrere lægemidlerDe to ikke-overlejrede spejlbilleder af en chiral metaloverflade på atomskala. Kredit:Professor Andrew Gellman I 1960erne, det beroligende middel thalidomid var meget populært som et af de eneste
- Former nye stjerner i nebulas?
- Ozonforureningen i Tyskland falder takket være lavere nitrogenoxidemissioner
- Lovende begyndelse for Australiens nyeste supercomputer
- Forskere fanger spændende magnetiske bølger i aktion i Solens fotosfære
- En forbedret metode til visualisering af proteinkrystalstruktur
- Hvad er de to måder, elektrisk strøm kan rejse, mens energi -enheder og hjem?


