Hvad er en Brønsted-Lowry Acid?
Her er en sammenbrud:
* Protoner: Disse er hydrogenioner (H+).
* Donation: Syren giver væk et proton til et andet molekyle.
Nøgleegenskaber ved Brønsted-Lowry-syrer:
* De indeholder mindst et hydrogenatom, der kan ioniseres (frigives som en proton).
* De øger koncentrationen af H+ -ioner i en løsning.
* De reagerer med baser for at danne en konjugat base og en konjugatsyre.
Eksempler på Brønsted-lowry syrer:
* saltsyre (HCL): HCl → H++ Cl- (donerer en proton til dannelse af H+ og Cl-)
* eddikesyre (CH3COOH): CH3COOH → H++ CH3COO- (donerer en proton til dannelse af H+ og acetation)
* svovlsyre (H2SO4): H2SO4 → H++ HSO4- (donerer en proton til dannelse af H+ og bisulfate ion)
Vigtig note:
* Brønsted-lowry-teorien er en mere omfattende definition af syrer og baser sammenlignet med Arrhenius-teorien. Det begrænser ikke definitionen til vandige løsninger og udvider konceptet til at omfatte protonoverførselsreaktioner i andre opløsningsmidler.
Sidste artikelHvad er sammensat sammensat af molekyler kaldet?
Næste artikelHvad er formålet med isotopmærkning?
 Varme artikler
Varme artikler
-
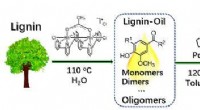 Ny strategi designet til bæredygtig produktion af benzylaminer fra ligninBæredygtig produktion af benzylaminer fra lignin. Kredit:LI Changzhi Benzylaminer, en type N-funktionaliserede aromater, anvendes i vid udstrækning som forløbere for lægemidler og syntetiske farve
Ny strategi designet til bæredygtig produktion af benzylaminer fra ligninBæredygtig produktion af benzylaminer fra lignin. Kredit:LI Changzhi Benzylaminer, en type N-funktionaliserede aromater, anvendes i vid udstrækning som forløbere for lægemidler og syntetiske farve -
 Ny svampedræbende forbindelse fra myrfarmeKredit:CC0 Public Domain Attmyrer er landmænd, og de dyrker svamp som føde. Pseudonocardia og Streptomyces bakterier er deres gårdmænd, producerer metabolitter, der beskytter afgrøden mod patogene
Ny svampedræbende forbindelse fra myrfarmeKredit:CC0 Public Domain Attmyrer er landmænd, og de dyrker svamp som føde. Pseudonocardia og Streptomyces bakterier er deres gårdmænd, producerer metabolitter, der beskytter afgrøden mod patogene -
 Registrering af forurening med en kompakt laserkildeKredit:Ecole Polytechnique Federale de Lausanne (EPFL) Forskere ved EPFL er kommet med en ny mellem infrarød lyskilde, der kan registrere drivhusgasser og andre gasser, samt molekyler i en persons
Registrering af forurening med en kompakt laserkildeKredit:Ecole Polytechnique Federale de Lausanne (EPFL) Forskere ved EPFL er kommet med en ny mellem infrarød lyskilde, der kan registrere drivhusgasser og andre gasser, samt molekyler i en persons -
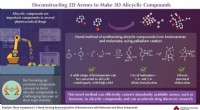 Ny metode kan effektivt skabe flere byggesten af farmaceutiske lægemidlerEn ny metode, der lover at fremskynde forskning i lægemidler til flere sygdomme. Kredit:Waseda University Flere lægemidler, herunder dem til depression, skizofreni, og malaria, ville ikke eksister
Ny metode kan effektivt skabe flere byggesten af farmaceutiske lægemidlerEn ny metode, der lover at fremskynde forskning i lægemidler til flere sygdomme. Kredit:Waseda University Flere lægemidler, herunder dem til depression, skizofreni, og malaria, ville ikke eksister
- Forskere skaber vandnedbrydelig plast, der kombinerer stivelse og cellulose
- I hvilken fase måne er mellem jord og sol?
- Hvad har celler ikke vira?
- Den store kommer. Her er, hvordan vi ved, og hvordan man overlever
- Hvad er navnene på kendte videnskabsmænd i Belize. 3?
- Hvordan butikstyve berettiger tyveri i supermarkedets selvbetjeningskasser


