Hvilken egenskab ved væsker påvirkes af styrkenattraktionen mellem molekyler?
* Viskositet: Dette henviser til en væskes modstand mod flow. Stærkere intermolekylære kræfter fører til højere viskositet, da molekylerne er mere tæt bundet og kræver mere energi for at bevæge sig forbi hinanden.
* damptryk: Dette er det tryk, der udøves af dampen af en væske ved en given temperatur. Stærkere intermolekylære kræfter fører til lavere damptryk, da molekylerne er mindre tilbøjelige til at undslippe i gasfasen.
* kogepunkt: Temperaturen, hvormed en væske skifter til en gas. Stærkere intermolekylære kræfter fører til højere kogepunkter, da der er behov for mere energi for at overvinde attraktionerne mellem molekylerne.
* overfladespænding: Dette er tendensen til en væskens overflade til at modstå strækning eller brud. Stærkere intermolekylære kræfter fører til højere overfladespænding, da molekylerne på overfladen er stærkere tiltrukket af hinanden.
* opløselighed: Et stofs evne til at opløses i en væske. Mens typen af intermolekylære kræfter er afgørende, spiller deres styrke også en rolle. Stærkere interaktioner mellem opløst stof og opløsningsmiddelmolekyler fører ofte til højere opløselighed.
Sammenfattende er styrken af intermolekylære kræfter en afgørende faktor til bestemmelse af væskernes fysiske egenskaber.
Sidste artikelHvad er den kemiske formel for element neodymium?
Næste artikelInd i hvilke elementer forfaldes uran 235?
 Varme artikler
Varme artikler
-
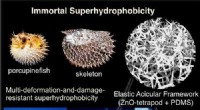 Porcupinefish inspirerer robust superhydrofobt materialeKredit:American Chemical Society Naturen har udviklet et blændende udvalg af materialer, der hjælper organismer med at trives i forskellige levesteder. Sommetider, videnskabsmænd kan udnytte disse
Porcupinefish inspirerer robust superhydrofobt materialeKredit:American Chemical Society Naturen har udviklet et blændende udvalg af materialer, der hjælper organismer med at trives i forskellige levesteder. Sommetider, videnskabsmænd kan udnytte disse -
 Forbedring af varmegenanvendelse med termodiffusionseffektenKredit:CC0 Public Domain Absorptionsvarme transformatorer kan effektivt genbruge spildvarmen, der genereres i forskellige industrier. I disse enheder, specialiserede væsker danner tynde film, når
Forbedring af varmegenanvendelse med termodiffusionseffektenKredit:CC0 Public Domain Absorptionsvarme transformatorer kan effektivt genbruge spildvarmen, der genereres i forskellige industrier. I disse enheder, specialiserede væsker danner tynde film, når -
 Venetiansk læge havde en central rolle i udformningen af den tidlige moderne kemiSantorios marginale note til kol. 406C-D, i Santorio Santori, Commentaria In Primam Fen Primi Libri Canonis Avicennae (Venedig, 1625), British Library, 542.h.11. Kredit:Santorios marginale note til ko
Venetiansk læge havde en central rolle i udformningen af den tidlige moderne kemiSantorios marginale note til kol. 406C-D, i Santorio Santori, Commentaria In Primam Fen Primi Libri Canonis Avicennae (Venedig, 1625), British Library, 542.h.11. Kredit:Santorios marginale note til ko -
 Forskerteam hjælper Arcteryx med at forblive grønt og tørt med næste generations vandafvisende t…UBC Okanagan-forskere Sadaf Shabanian (til venstre) og Kevin Golovin (til højre) tester vandafvisende stofbehandling. Kredit:UBC Okanagan En bæredygtig, giftfrit og højtydende vandafvisende stof h
Forskerteam hjælper Arcteryx med at forblive grønt og tørt med næste generations vandafvisende t…UBC Okanagan-forskere Sadaf Shabanian (til venstre) og Kevin Golovin (til højre) tester vandafvisende stofbehandling. Kredit:UBC Okanagan En bæredygtig, giftfrit og højtydende vandafvisende stof h
- Hvad hedder det, når lysstyrken på en stjernestjerners målbar i skala?
- Hvis bagepulver reagerer med eddike og danner en gas, er det kemisk eller fysisk?
- Hvilket organ, der indeholder en stærk syre?
- Hvilken æra sluttede med Jorden dækket af massive ørkener?
- Hvordan man identificerer metamorfe klipper
- Hvordan blev solenergi brugt i fortiden?


