Hvordan måler man pH -værdien ved hjælp af brintelektrode?
Forståelse af brintelektroden
* princip: Hydrogenelektroden er en referencelektrode, der etablerer et standardpotentiale baseret på ligevægten mellem brintioner (H+) og brintgas (H2). Det er grundlaget for pH -skalaen.
* opsætning: En platinelektrode er nedsænket i en opløsning, der indeholder hydrogenioner. Brintgas bobles over elektrodeoverfladen.
* nernst ligning: Elektrodens potentiale er direkte relateret til koncentrationen af brintioner (og dermed pH) via Nernst -ligningen:
E =E ° + (RT/NF) * LN (AH +)
Hvor:
* E =elektrodepotentiale
* E ° =standard elektrodepotentiale (0,000 V ved 25 ° C)
* R =ideel gaskonstant
* T =absolut temperatur
* n =antal overførte elektroner (1 i dette tilfælde)
* F =Faradays konstant
* AH+ =aktivitet af hydrogenioner (ca. lig med koncentrationen i fortyndede opløsninger)
procedure
1. Forbered brintelektroden:
* Sørg for, at platinelektroden er ren og fri for forurenende stoffer.
* Mæt opløsningen med brintgas (brug en bobler).
* Oprethold et konstant tryk på brintgas.
2. Forbered referencelektroden:
* Brug en standardreferencelektrode (f.eks. En mættet calomel -elektrode (SCE) eller sølv/sølvchloridelektrode (Ag/AgCl)).
3. Tilslut elektroderne:
* Tilslut brintelektroden og referencelektroden til et højimpedansvoltmeter eller pH-meter.
4. nedsænker elektroderne:
* Skriv elektroderne i den løsning, du vil måle pH af.
5. Mål potentialforskellen:
* Voltmeteren viser den potentielle forskel mellem brintelektroden og referencelektroden.
6. Beregn pH:
* Brug NERNST -ligningen til at beregne pH fra den målte potentialeforskel. Alternativt kalibreres mange pH -målere til direkte at vise pH -værdien.
Vigtige overvejelser
* Temperatur: Nernst-ligningen er temperaturafhængig. Sørg for, at temperaturen er kendt og redegøres for i beregningen.
* Løsningsbetingelser: PH -målingen kan påvirkes af faktorer, såsom ionstyrke, opløste gasser og tilstedeværelsen af redox -aktive arter.
* Elektrodestabilitet: Hydrogenelektroder kan være følsomme over for forgiftning af visse stoffer. Oprethold korrekt rengørings- og håndteringsprocedurer.
alternativer til brintelektroder
Mens brintelektroder er grundlæggende, er de ikke altid praktiske. Andre, mere praktiske metoder er tilgængelige til måling af pH, såsom:
* glaselektroder: Dette er de mest almindelige og vidt anvendte elektroder til pH -måling. De er relativt billige, lette at bruge og bærbare.
* Kombinationselektroder: Disse elektroder integrerer både referencelektroden og sensorelektroden i en enkelt enhed, hvilket forenkler opsætningen.
Fortæl mig, hvis du gerne vil have en mere detaljeret forklaring af nogen af disse aspekter, eller hvis du har andre spørgsmål om pH -måling!
Sidste artikelHvad gør kaffe til et rent stof?
Næste artikelHvad er handlingen af varme på magnesiumchlorid?
 Varme artikler
Varme artikler
-
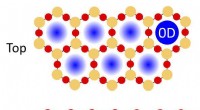 Dækning af metalkatalysatoroverflader med tynde todimensionale oxidmaterialer kan forbedre kemiske …En illustration af fysisk lukkede rum i en porøs dobbeltlags silica film på en metalkatalysator, der kan bruges til kemiske reaktioner. Siliciumatomer er angivet med de orange cirkler; iltatomer ved d
Dækning af metalkatalysatoroverflader med tynde todimensionale oxidmaterialer kan forbedre kemiske …En illustration af fysisk lukkede rum i en porøs dobbeltlags silica film på en metalkatalysator, der kan bruges til kemiske reaktioner. Siliciumatomer er angivet med de orange cirkler; iltatomer ved d -
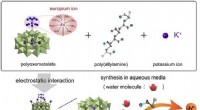 Hybridmateriale flytter næste generations transportbrændstofceller tættere påUltrahøj protonkonduktion i polyoxometalatbaseret ramme Billedtekst:Ultrahøj protonkonduktion via udvidet hydrogenbindingsnetværk i polyoxometalatbaseret ramme, der er funktionaliseret med Lanthanide
Hybridmateriale flytter næste generations transportbrændstofceller tættere påUltrahøj protonkonduktion i polyoxometalatbaseret ramme Billedtekst:Ultrahøj protonkonduktion via udvidet hydrogenbindingsnetværk i polyoxometalatbaseret ramme, der er funktionaliseret med Lanthanide -
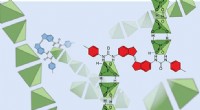 Skinner lys over den underlige verden af dihydrogenphosphatanionerRepræsentation, der viser dihydrogenphosphater (i grønt), der binder sammen i opløsning. Kredit:UNSW Forskere ved UNSW Sydney, sammen med samarbejdspartnere fra Western Sydney University og Hollan
Skinner lys over den underlige verden af dihydrogenphosphatanionerRepræsentation, der viser dihydrogenphosphater (i grønt), der binder sammen i opløsning. Kredit:UNSW Forskere ved UNSW Sydney, sammen med samarbejdspartnere fra Western Sydney University og Hollan -
 Pulserne stiger, da ny undersøgelse afslører plantens hemmeligheder, der holder folk i roBeroligende indflydelse -- Indisk Snakeroot. Kredit:John Innes Center Kemiske hemmeligheder for en plante, der er blevet brugt gennem historien for dens beroligende virkning, er blevet afsløret i
Pulserne stiger, da ny undersøgelse afslører plantens hemmeligheder, der holder folk i roBeroligende indflydelse -- Indisk Snakeroot. Kredit:John Innes Center Kemiske hemmeligheder for en plante, der er blevet brugt gennem historien for dens beroligende virkning, er blevet afsløret i
- Sjældne jordarter låser kobber op, guld og sølv hemmeligheder
- Børnebøger skal være mangfoldige, eller børn vil vokse op med at tro, at hvid er overlegen
- Hvor mange celler skal være sammen tæller som væv?
- Er emissionen af elektromagnetisk stråling med et ophidset atom en bølge- eller partikelteori?
- Hvordan påvirker flerårigt græsarealdækning anderedens overlevelse?
- Hvor lang tid ville det tage at få Pluto fra Merkur?


