Hvorfor er amider opløselige i vand?
1. Amidstruktur:
* Polaritet: Amides har en polær carbonylgruppe (C =O) og et nitrogenatom, der kan deltage i hydrogenbinding. Tilstedeværelsen af alkylgrupperne, der er fastgjort til nitrogenet, kan imidlertid gøre molekylet mindre polært generelt.
* Hydrogenbinding: Mens amider kan danne hydrogenbindinger med vandmolekyler, er styrken af disse bindinger relativt svag på grund af den elektronoptagende virkning af carbonylgruppen.
2. Faktorer, der påvirker opløselighed:
* kædelængde: Tilstedeværelsen af lange alkylkæder, der er fastgjort til nitrogenet, reducerer molekylets polaritet, hvilket gør det mindre opløseligt i vand. Kortere kædeamider er mere opløselige.
* Substituenter: Elektron-donerende grupper på nitrogenatomet øger molekylets polaritet og fremmer opløselighed i vand.
* Temperatur: Opløselighed øges med temperaturen.
3. Sammenligning med andre funktionelle grupper:
* aminer: Aminer er generelt mere opløselige i vand end amider på grund af deres højere evne til at danne brintbindinger.
* Alkoholer: Alkoholer har også højere opløselighed i vand end amider på grund af den stærke hydrogenbinding mellem hydroxylgruppen (OH) og vand.
Konklusion:
Mens Amides har potentialet for hydrogenbinding, begrænser deres samlede polaritet og tilstedeværelsen af alkylgrupper ofte deres opløselighed i vand. Mindre, mindre substituerede amider kan have større opløselighed, men generelt er de mindre opløselige end alkoholer og aminer.
Sidste artikelHvilket kemikalie bruges til påvisning af sulfat i vandig opløsning?
Næste artikelHvad er elementerne til stede i C17H21N04?
 Varme artikler
Varme artikler
-
 Video:Hollywood-blodbadenes kemiFalsk blod er en fast bestanddel af Halloween-gyserfilmoplevelsen, men der er ikke én opskrift, der passer til enhver filmskabers behov. Kemien for falsk blod er altid blevet justeret for at skabe den
Video:Hollywood-blodbadenes kemiFalsk blod er en fast bestanddel af Halloween-gyserfilmoplevelsen, men der er ikke én opskrift, der passer til enhver filmskabers behov. Kemien for falsk blod er altid blevet justeret for at skabe den -
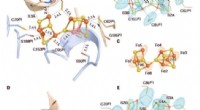 Strukturelt bevis for en dynamisk metallocofaktor under dinitrogenreduktion ved Mo-nitrogenaseDe oxiderede P-klynger i Av1*. Strukturer af P-klynger ved (A til C) grænsefladen mellem kæder A og B [P-klynge (A/B)] og (D til F) grænsefladen mellem kæder C og D [P-klynge (C/D) ] af Av1*. Kæder A
Strukturelt bevis for en dynamisk metallocofaktor under dinitrogenreduktion ved Mo-nitrogenaseDe oxiderede P-klynger i Av1*. Strukturer af P-klynger ved (A til C) grænsefladen mellem kæder A og B [P-klynge (A/B)] og (D til F) grænsefladen mellem kæder C og D [P-klynge (C/D) ] af Av1*. Kæder A -
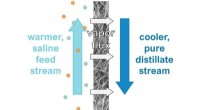 Hvordan gør man et bedre stykke arbejde med at rense saltvand? Ved at holde afsaltningsværktøj tø…Den varme vandstrøm med høj saltholdighed er på den ene side af membranen og en kølig ren vandstrøm på den anden. det opvarmede vand fordamper, efterlader saltet og danner en damp, som omdannes til en
Hvordan gør man et bedre stykke arbejde med at rense saltvand? Ved at holde afsaltningsværktøj tø…Den varme vandstrøm med høj saltholdighed er på den ene side af membranen og en kølig ren vandstrøm på den anden. det opvarmede vand fordamper, efterlader saltet og danner en damp, som omdannes til en -
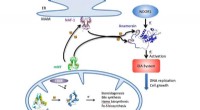 MiNT -protein et nyt mål for at angribe sygdomEn illustration skitserer NEET-cyklussen i celler, hvormed jern-svovlklynger leveres af MiNT, mitoNEET (mNT) og NAF-1 proteiner i cytosolen eller mitokondrierne (bunden) til en række cellulære metabol
MiNT -protein et nyt mål for at angribe sygdomEn illustration skitserer NEET-cyklussen i celler, hvormed jern-svovlklynger leveres af MiNT, mitoNEET (mNT) og NAF-1 proteiner i cytosolen eller mitokondrierne (bunden) til en række cellulære metabol
- Forskere udvikler nyt magnetisk nanomateriale til forebyggelse af falske penge
- Aerosolpartikler køler klimaet mindre, end vi troede
- En robot i hvert hjem? (Robot Special del 3)
- Ledere overvurderer vildt de økonomiske fordele ved strategiplanlægning
- Hvorfor udsender solen lys?
- To matematikere forklarer, hvordan bygning af broer inden for disciplinen hjalp med at bevise Fermat…


