Hvilken kemisk familie er brint i?
Her er hvorfor:
* Elektronkonfiguration: Hydrogen har kun en proton og en elektron, hvilket giver den en simpel elektronisk konfiguration af 1s¹. Dette ligner alkalimetaller.
* reaktivitet: Ligesom alkalimetaller er brint meget reaktivt og danner let bindinger med andre elementer.
* ionisk opførsel: Hydrogen kan miste sin elektron for at danne en positiv ion (H+), svarende til andre alkalimetaller.
Men her er hvorfor brint ofte betragtes som et unikt element:
* Fysiske egenskaber: Hydrogen er en gas ved stuetemperatur, i modsætning til de andre alkalimetaller, der er faste stoffer.
* Kemisk opførsel: Hydrogen kan også få et elektron til dannelse af en negativ ion (H-), i modsætning til andre alkalimetaller. Det kan også danne kovalente bindinger, i modsætning til den primært ioniske binding, der ses i andre alkalimetaller.
Selvom brint deler nogle ligheder med alkalimetaller, udviser det derfor også unikke egenskaber, der adskiller det. Det klassificeres ofte separat som et unikt element med sine egne karakteristiske kemiske og fysiske egenskaber.
 Varme artikler
Varme artikler
-
 Højhastigheds FM-AFM og simulering afslører atomistiske opløsningsprocesser af calcit i vand(a) Atomistisk model af calcitoverflade. (b) Opløsningsprocesserne af calcitoverflade i vand observeret med højhastigheds FM-AFM. Det observeres, at trinnet bevæger sig fra nederste højre til øverste
Højhastigheds FM-AFM og simulering afslører atomistiske opløsningsprocesser af calcit i vand(a) Atomistisk model af calcitoverflade. (b) Opløsningsprocesserne af calcitoverflade i vand observeret med højhastigheds FM-AFM. Det observeres, at trinnet bevæger sig fra nederste højre til øverste -
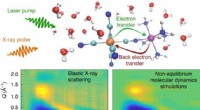 Forskere får indsigt i, hvordan opløsningsmiddelmolekyler påvirker lysdrevne reaktionerAbstrakt. Kredit: Naturkemi (2021). DOI:10.1038/s41557-020-00629-3 Lysabsorberende molekyler kan omdanne fotoner til elektricitet eller brændstoffer ved at skifte elektroner fra et atom til et an
Forskere får indsigt i, hvordan opløsningsmiddelmolekyler påvirker lysdrevne reaktionerAbstrakt. Kredit: Naturkemi (2021). DOI:10.1038/s41557-020-00629-3 Lysabsorberende molekyler kan omdanne fotoner til elektricitet eller brændstoffer ved at skifte elektroner fra et atom til et an -
 Et skridt nærmere biotekniske erstatninger for skibe og kanalerKredit:CC0 Public Domain Et team af forskere fra Brigham og Womens Hospital har udviklet en måde at bioprinte rørformede strukturer på, der bedre efterligner oprindelige kar og kanaler i kroppen.
Et skridt nærmere biotekniske erstatninger for skibe og kanalerKredit:CC0 Public Domain Et team af forskere fra Brigham og Womens Hospital har udviklet en måde at bioprinte rørformede strukturer på, der bedre efterligner oprindelige kar og kanaler i kroppen. -
 AI fremskynder udviklingen af nye legeringer med høj entropiNye materialer, der anvender AI til at udvikle højentropi-legeringer (HEAer), der er opfundet som legeringer af legeringer. Kredit:Seungchul Lee (POSTECH) Det tager meget tid at udvikle nye materi
AI fremskynder udviklingen af nye legeringer med høj entropiNye materialer, der anvender AI til at udvikle højentropi-legeringer (HEAer), der er opfundet som legeringer af legeringer. Kredit:Seungchul Lee (POSTECH) Det tager meget tid at udvikle nye materi
- Hvilke karrierer bruger teleskoper?
- Floridas soldater står over for mere varmefare fra klimaændringer end nogen anden stat
- Hvad er der galt med den kemiske formel svovloxid?
- Hvordan man opbygger et kabel-Opholdt Bridge
- Hvad er et andet navn på lysafhængige reaktioner af fotosyntesen?
- Hvordan klassificeres vulkaner, der er udbrudt i den nylige historie?


