Hvordan adskiller vandtætheder som en solid og væske sig fra de fleste andre stoffer?
Hvorfor de fleste stoffer er tættere som faste stoffer:
* Luk pakning: Når stoffer størkner, pakker deres molekyler tættere sammen, hvilket øger densiteten. Dette skyldes, at molekylerne har mindre frihed til at bevæge sig rundt og slå sig ned i en mere organiseret, kompakt struktur.
Hvorfor is er mindre tæt end vand:
* Hydrogenbinding: Vandmolekyler danner stærke brintbindinger med hinanden. Disse bindinger er ansvarlige for mange af vandets unikke egenskaber.
* åben struktur af is: Når vand fryser, tvinger hydrogenbindingerne molekylerne til at arrangere sig selv i en stiv, krystallinsk struktur med relativt store tomme rum mellem dem. Denne åbne, hexagonale struktur er mindre kompakt end det tilfældige arrangement af vandmolekyler i flydende form.
Konsekvenser af vandets unikke egenskab:
* is flyder: Den nedre tæthed af is får den til at flyde på vand, en afgørende faktor for akvatisk liv. Det forhindrer søer og oceaner i at fryse fast stof, hvilket giver akvatiske økosystemer mulighed for at overleve selv i kolde klimaer.
* isolering: I islag på vandoverfladen fungerer som en isolator, hvilket forhindrer yderligere afkøling af vandet nedenfor.
Kortfattet:
Den usædvanlige opførsel af vand i relation til densitet skyldes den stærke hydrogenbinding mellem dens molekyler. Denne binding fører til en mindre kompakt struktur i fast tilstand, hvilket gør is mindre tæt end flydende vand. Denne ejendom har betydelige konsekvenser for livet på jorden.
 Varme artikler
Varme artikler
-
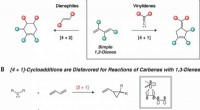 En måde at bruge en to-nikkel katalysator til at syntetisere cyclopentenerReaktionsudvikling. (A) Komplementære cykloadditionsruter til fem- og seksleddede ringe fra 1, 3-diener. (B) Pericykliske [4 + 1]-cykloadditioner lider af store elektroniske barrierer på grund af fras
En måde at bruge en to-nikkel katalysator til at syntetisere cyclopentenerReaktionsudvikling. (A) Komplementære cykloadditionsruter til fem- og seksleddede ringe fra 1, 3-diener. (B) Pericykliske [4 + 1]-cykloadditioner lider af store elektroniske barrierer på grund af fras -
 Personlig svedsensor overvåger pålideligt blodsukkeret uden fingerstikEn håndholdt enhed kombineret med en berøringssvedsensor (strimmel til højre) måler glukose i sved, mens en personlig algoritme konverterer disse data til et blodsukkerniveau. Kredit: ACS sensorer (2
Personlig svedsensor overvåger pålideligt blodsukkeret uden fingerstikEn håndholdt enhed kombineret med en berøringssvedsensor (strimmel til højre) måler glukose i sved, mens en personlig algoritme konverterer disse data til et blodsukkerniveau. Kredit: ACS sensorer (2 -
 Forskere opdager nye ikke-klæbende gelerBillede af ikke-klæbende gel, der tager ved hjælp af avancerede 3D-lysmikroskopiteknikker. Kredit:University of Bristol Forskere fra University of Bristol og Université Paris-Saclay har opdaget en
Forskere opdager nye ikke-klæbende gelerBillede af ikke-klæbende gel, der tager ved hjælp af avancerede 3D-lysmikroskopiteknikker. Kredit:University of Bristol Forskere fra University of Bristol og Université Paris-Saclay har opdaget en -
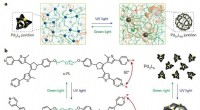 Lysstyrede polymerer kan skifte mellem robuste og blødeDesign af polyMOCer med fotoskiftbar topologi. Kredit:(c) Natur (2018). DOI:10.1038/s41586-018-0339-0 MIT -forskere har designet et polymermateriale, der kan ændre dets struktur som reaktion på
Lysstyrede polymerer kan skifte mellem robuste og blødeDesign af polyMOCer med fotoskiftbar topologi. Kredit:(c) Natur (2018). DOI:10.1038/s41586-018-0339-0 MIT -forskere har designet et polymermateriale, der kan ændre dets struktur som reaktion på
- Hvad er temperaturen på stjerne Mira Ceti?
- Rydning af polarluften på kosmisk støv
- Hvad er de intermolekylære tiltrækningskræfter i pentan?
- Klimaændringernes antropologi og gletsjertilbagetrækning
- Når en glasstav gnides med silkeklæde, hvilket stof mister elektron?
- Hvad er en godt blandet blanding, der ser ud til at være et enkelt stof?


