Ved hvilken temperatur ville en reaktion med H -92 kJ mol S -199 molk være spontan?
Forståelse af spontanitet
* spontanitet Henviser til, om en reaktion vil forekomme uden ekstern energiindgang.
* gibbs fri energi (ΔG) er en termodynamisk mængde, der forudsiger spontanitet:
* ΔG <0: Reaktion er spontan (favoriserer produktdannelse)
* ΔG> 0: Reaktion er ikke-spontan (kræver energiindgang)
* ΔG =0: Reaktion er i ligevægt
Ligningen for Gibbs Free Energy
Forholdet mellem Gibbs fri energi (ΔG), enthalpy (ΔH), entropi (ΔS) og temperatur (T) er:
`` `
ΔG =ΔH - TΔS
`` `
* ΔH: Enthalpy Change (varme absorberet eller frigivet)
* Negativ ΔH:Exoterm (frigiver varme)
* Positiv ΔH:endotermisk (absorberer varme)
* ΔS: Entropiændring (ændring i lidelse)
* Positive ΔS:Forøgelse i lidelse
* Negativ ΔS:Fald i uorden
* t: Temperatur (i Kelvin)
hvad vi har brug for
For at bestemme den temperatur, hvorpå reaktionen er spontan, har vi brug for:
1. entalpiændring (ΔH): Du leverede "-92 kJ mol", men enheden skal være "KJ/mol". Vi antager, at dette er entalpiændringen, og den er eksoterme (negativ værdi).
2. entropiændring (ΔS): Du leverede "-199 MOLK", som virker ufuldstændig. Enheden skal være "j/mol · k". Angiv den korrekte entropiændringsværdi.
Løsning for temperatur
1. sæt ΔG =0: En reaktion bliver spontan, når ΔG bliver negativ. Vi finder temperaturen, hvor ΔG =0, som er overgangspunktet fra ikke-spontan til spontan.
2. tilslut værdier: Udskift den givne ΔH og ΔS i ligningen.
3. Løs for t: Omarranger ligningen for at løse for temperatur (t).
Eksempel (forudsat ΔS =+100 J/mol · K)
Lad os antage, at entropiændringen er positiv (favoriserer spontanitet).
1. ΔG =0
2. 0 =-92 kJ/mol - t (100 j/mol · k)
3. t =(-92 kJ/mol)/(100 j/mol · k)
* Husk at konvertere KJ til J:T =(-92000 j/mol)/(100 j/mol · k)
4. t =-920 k
vigtige noter
* Temperatur i Kelvin: Brug altid Kelvin (K) til temperatur i termodynamiske beregninger.
* enheder: Sørg for, at enheder er konsistente i hele ligningen.
* entropi: En positiv entropiændring favoriserer normalt spontanitet.
Angiv den korrekte værdi for entropiændringen (ΔS), så jeg kan give dig et endeligt svar på den temperatur, hvorpå reaktionen vil være spontan.
 Varme artikler
Varme artikler
-
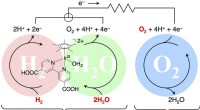 Forskere efterligner to naturlige energiprocesser med en enkelt katalysatorDen røde cirkel (H2) repræsenterer en brændselscelleanode mønstret efter hydrogenase, en elektrode, hvor elektroner (e-) strømmer ud til et eksternt kredsløb. Den grønne cirkel (H2O) viser en solcelle
Forskere efterligner to naturlige energiprocesser med en enkelt katalysatorDen røde cirkel (H2) repræsenterer en brændselscelleanode mønstret efter hydrogenase, en elektrode, hvor elektroner (e-) strømmer ud til et eksternt kredsløb. Den grønne cirkel (H2O) viser en solcelle -
 Enkelt fotonemission fra isolerede monolagsøer af InGaNen, TEM-tværsnitsbillede af en In(Ga)N/GaN enkelt enkeltlags-ø. b, Et HAADF-STEM-billede med høj forstørrelse af In(Ga)N enkelt atomare monolag, mens det øverste panel viser det tilsvarende atomdiagra
Enkelt fotonemission fra isolerede monolagsøer af InGaNen, TEM-tværsnitsbillede af en In(Ga)N/GaN enkelt enkeltlags-ø. b, Et HAADF-STEM-billede med høj forstørrelse af In(Ga)N enkelt atomare monolag, mens det øverste panel viser det tilsvarende atomdiagra -
 Løsning af problemet:Organisk damp inducerer opløsning af molekylære salteForskere fra Institute of Industrial Science, University of Tokyo, finder ud af, at organiske dampe kan inducere opløsning af molekylære salte (dvs. organisk delikvence), svarende til vanddamp-inducer
Løsning af problemet:Organisk damp inducerer opløsning af molekylære salteForskere fra Institute of Industrial Science, University of Tokyo, finder ud af, at organiske dampe kan inducere opløsning af molekylære salte (dvs. organisk delikvence), svarende til vanddamp-inducer -
 En vej til fremtiden, belagt med keramikReeja Jayan og hendes forskerhold undersøger, hvordan elektromagnetiske felter fremskynder keramisk fremstilling, finde både udfordringer og stort potentiale. Kredit:College of Engineering, Carnegie M
En vej til fremtiden, belagt med keramikReeja Jayan og hendes forskerhold undersøger, hvordan elektromagnetiske felter fremskynder keramisk fremstilling, finde både udfordringer og stort potentiale. Kredit:College of Engineering, Carnegie M
- Hvad sker der med elementært kobber, når det mister to elektroner?
- Forskere 3D-print roterende mikrofilter til laboratorie-på-en-chip-applikationer
- Ekstreme begivenheder:Økosystemer tilbyder omkostningseffektiv beskyttelse
- Hvad ser du, når du lytter til musik?
- Har du brug for et job? Få tatovering
- Hvornår er månen tættest på jorden i sin bane?


