Hvad betyder det, når et molekyle bliver mere negativt?
* Elektronegativitet: Dette er et mål for et atoms evne til at tiltrække elektroner mod sig selv i en kemisk binding. Atomer med højere elektronegativitet har en tendens til at trække elektroner nærmere, hvilket skaber en delvis negativ ladning på sig selv.
* polære molekyler: Når to atomer med signifikant forskellige elektronegativiteter binder, trækkes elektronerne mod det mere elektronegative atom. Dette skaber et polært molekyle , hvor den ene ende har en delvis negativ ladning (Δ-), og den anden ende har en delvis positiv ladning (Δ+).
* Elektrondensitet: Det "mere negative" aspekt, du henviser til, er relateret til koncentrationen af elektroner i et molekyle. Når elektroner trækkes mod et bestemt atom eller område af et molekyle, øges elektrondensiteten, hvilket gør dette område mere elektronegativt.
her er et simpelt eksempel:
* vand (H2O): Oxygen er mere elektronegativ end brint. Dette får de delte elektroner i O-H-bindingerne til at blive trukket tættere på iltatomet, hvilket giver det en delvis negativ ladning (Δ-) og hydrogenerne en delvis positiv ladning (δ+).
Vigtig note: Molekyler vinder eller mister ikke elektroner for at blive mere negative. I stedet distribution af elektroner ændringer på grund af forskelle i elektronegativitet, hvilket skaber områder med højere og lavere elektrondensitet inden for molekylet.
Sidste artikelHvad er syreværdien af polymerer?
Næste artikelHvad er formålet med at forberede et eksemplar i metallografi?
 Varme artikler
Varme artikler
-
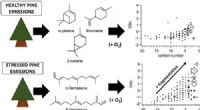 Bladlusstressede fyrretræer viser forskellig sekundær organisk aerosoldannelseKredit:American Chemical Society Planter udsender gasser, kaldet flygtige organiske forbindelser (VOCer), der kommer ind i atmosfæren, hvor de kan interagere med andre naturlige og menneskeskabte
Bladlusstressede fyrretræer viser forskellig sekundær organisk aerosoldannelseKredit:American Chemical Society Planter udsender gasser, kaldet flygtige organiske forbindelser (VOCer), der kommer ind i atmosfæren, hvor de kan interagere med andre naturlige og menneskeskabte -
 Forskere finder nøglen til at bevare SkrigetSkriget (1910?) (Munch Museum, Oslo; katalog n. Woll.M.896). Kredit:Irina Crina Anca Sandu og Eva Storevik Tveit, Munch Museum. Skriget er blandt de mest berømte malerier i den moderne æra. Det ve
Forskere finder nøglen til at bevare SkrigetSkriget (1910?) (Munch Museum, Oslo; katalog n. Woll.M.896). Kredit:Irina Crina Anca Sandu og Eva Storevik Tveit, Munch Museum. Skriget er blandt de mest berømte malerier i den moderne æra. Det ve -
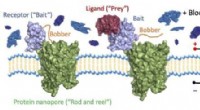 Forskere udvikler molekylær fiskeri for at finde individuelle molekyler i blodDenne figur illustrerer en protein-nanopore-baseret sensor til påvisning af proteiner i en kompleks biologisk væske ved enkeltmolekylær præcision. På venstre side, sensoren, som er et konstrueret tran
Forskere udvikler molekylær fiskeri for at finde individuelle molekyler i blodDenne figur illustrerer en protein-nanopore-baseret sensor til påvisning af proteiner i en kompleks biologisk væske ved enkeltmolekylær præcision. På venstre side, sensoren, som er et konstrueret tran -
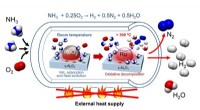 Katalysator til kulstoffri produktion af brintgas fra ammoniakKredit:Katsutoshi Nagaoka (Phys.org)—Hydrogen har potentialet til at give et alternativ, ren energikilde, især når det gælder brændselscelleteknologi. Nuværende brændstofkilder involverer kulstofh
Katalysator til kulstoffri produktion af brintgas fra ammoniakKredit:Katsutoshi Nagaoka (Phys.org)—Hydrogen har potentialet til at give et alternativ, ren energikilde, især når det gælder brændselscelleteknologi. Nuværende brændstofkilder involverer kulstofh
- Er det sandt, at for at opretholde de ønskede egenskaber for en line organismer, der ofte bruger hy…
- Lipid nanopartikler, der leverer mRNA til T-celler, lover godt mod autoimmune sygdomme
- Hvad bruges til at hjælpe os med at forstå fænomenet?
- Forskning i lipidnanopartikler nærmer sig genetiske behandlinger for arvelig lungesygdom, synstab
- Casimir-kraft bruges til at kontrollere og manipulere objekter
- Astronomer tilbyder en ny model til dannelse af nyligt opdagede fritsvævende planeter


