Hvordan påvirker salt kogepunktet af vand?
* Kolligative egenskaber: Kogepunkthøjden forårsaget af salt er en kolligativ egenskab. Dette betyder, at det afhænger af antallet af opløste partikler (i dette tilfælde saltioner) opløst i opløsningsmidlet (vand), ikke typen af opløst stof.
* dissociation: Når salt (NaCl) opløses i vand, adskiller det sig i natriumioner (Na+) og chloridioner (Cl-). Disse ioner interagerer med vandmolekyler, hvilket gør det sværere for dem at flygte ind i dampfasen.
* damptryk: Tilstedeværelsen af opløste ioner sænker opløsningens damptryk. Dette betyder, at vandmolekylerne skal nå en højere temperatur til at have nok energi til at overvinde det reducerede damptryk og koge.
på enkle termer:
Tænk på saltionerne som at komme i vejen for vandmolekyler, der prøver at flygte og blive damp. De gør det sværere for vandet at koge, så det tager en højere temperatur at få det til at gøre det.
Vigtig note: Effekten af salt på kogepunktet er relativt lille. Tilsætning af en teskefuld salt til en gryde med vand øger kun kogepunktet med et par grader Fahrenheit.
 Varme artikler
Varme artikler
-
 At finde ud af, hvordan isformer kunne holde forruder, elledninger isfriOverfladeatomer på en støvpartikel (vist med rødt, hvid, pink og gul) påtvinger vandmolekyler (blå) et arrangement, der kan fremme eller hæmme isdannelse. Kredit:Sapna Sarupria og Ryan DeFever Hvo
At finde ud af, hvordan isformer kunne holde forruder, elledninger isfriOverfladeatomer på en støvpartikel (vist med rødt, hvid, pink og gul) påtvinger vandmolekyler (blå) et arrangement, der kan fremme eller hæmme isdannelse. Kredit:Sapna Sarupria og Ryan DeFever Hvo -
 At bryde vandmolekyler fra hinanden for at generere rent brændstof:Undersøgelse af et lovende mate…Fotoelektrokemisk vandopdeling. Vand kan spaltes for at opnå H 2 og O. 2 ved at anvende en lav spænding i et kredsløb som det, der er vist i figuren, ved hjælp af et passende fotoanodemateriale. H
At bryde vandmolekyler fra hinanden for at generere rent brændstof:Undersøgelse af et lovende mate…Fotoelektrokemisk vandopdeling. Vand kan spaltes for at opnå H 2 og O. 2 ved at anvende en lav spænding i et kredsløb som det, der er vist i figuren, ved hjælp af et passende fotoanodemateriale. H -
 Brug af en phosphinoxidkatalysator til at gøre nukleofile substitutionsreaktioner af alkoholer grø…Kredit:CC0 Public Domain Et team af forskere med University of Nottingham, Jealotts Hill International Research Center og GlaxoSmithKline, Medicinforskningscenter, har fundet en måde at bruge en p
Brug af en phosphinoxidkatalysator til at gøre nukleofile substitutionsreaktioner af alkoholer grø…Kredit:CC0 Public Domain Et team af forskere med University of Nottingham, Jealotts Hill International Research Center og GlaxoSmithKline, Medicinforskningscenter, har fundet en måde at bruge en p -
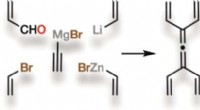 Anstrengt, symmetrisk, og nyt:Tetravinylallen, et lille, men kraftfuldt molekyle, er blevet syntetis…Kredit:Wiley Mange naturlige forbindelser, der bruges i medicin, har komplekse molekylære arkitekturer, som er svære at genskabe i laboratoriet. Hjælp kunne komme fra et lille kulbrintemolekyle, k
Anstrengt, symmetrisk, og nyt:Tetravinylallen, et lille, men kraftfuldt molekyle, er blevet syntetis…Kredit:Wiley Mange naturlige forbindelser, der bruges i medicin, har komplekse molekylære arkitekturer, som er svære at genskabe i laboratoriet. Hjælp kunne komme fra et lille kulbrintemolekyle, k
- Giver sure opløsninger nogle eller mange hydrogenioner?
- Hvad sker der, hvis et barn er født med et ekstra kromosom i den 23. par?
- Hvad er et bioinformatisk system?
- Hvad er skjult i kort tid under solarkering?
- Michigan meteor kunne hjælpe forskere med at forstå nærliggende jordtrusler
- Sådan regenereres aktivt kul


