Brug af en phosphinoxidkatalysator til at gøre nukleofile substitutionsreaktioner af alkoholer grønnere

Kredit:CC0 Public Domain
Et team af forskere med University of Nottingham, Jealott's Hill International Research Center og GlaxoSmithKline, Medicinforskningscenter, har fundet en måde at bruge en phosphinoxidkatalysator til at gøre nukleofile substitutionsreaktioner af alkoholer grønnere. I deres papir offentliggjort i tidsskriftet Videnskab , gruppen beskriver deres proces og dens fordele. Lars Longwitz og Thomas Werner fra Leibniz Institute for Catalysis har udgivet et Perspective-stykke, der beskriver det arbejde, som teamet har udført i samme tidsskriftsudgave.
Nukleofile substitutioner er en type substitutionsreaktion, der bruges i organisk kemi - de involverer at bruge en nukleofil til at erstatte en god afgangsgruppe. Sådanne reaktioner (Mitsunobu-kemi) bruges almindeligvis som en del af en proces til at syntetisere en lang række kommercielle produkter. Longwitz og Werner bemærker, at alkoholer typisk bruges som nukleofil, fordi de er billige og let tilgængelige. Men fordi alkoholer ikke reagerer med pronukleofiler, medmindre de er aktive før substitutionen, reaktionen fører til produktionen af et uønsket phosphinoxid-biprodukt - et mindre end rent resultat. I denne nye indsats, forskerne har fundet på en måde at undgå dette problem på, og giver således en meget renere metode til at vende konfigurationen af alkoholer.
Metoden udviklet af forskerne var otte år undervejs og involverede at bruge et fosphinoxid, som holdet designede, som ikke kræver reduktionsmidler eller oxidanter. Teknikken kræver ikke et azo-reagens. For at aktivere phosphinoxidkatalysatoren, de brugte sure protoner, der var beregnet til nukleofilen brugt i substitutionen. Næste, de dehydrerede katalysatoren, tvinger det ind i en ringformet struktur. Ved at gøre det skærer du fosfor-ilt-dobbeltbindingerne, hvilken, i tidligere bestræbelser, har vist sig at være ret svært. Dette gjorde det muligt for iltmolekyler at binde sig til fosforatomerne, tvang ringen til at åbne - og det gjorde det muligt for koblingspartneren at angribe det resulterende salt, som producerede slutproduktet. Processen producerer ikke kun vand som et biprodukt, men regenererer også katalysatoren. Longwitz og Werner foreslår, at metoden går en ny vej mod mere bæredygtig organisk syntese.
© 2019 Science X Network
 Varme artikler
Varme artikler
-
 Selvfugtende smarte kontaktlinserIllustration af en selvfugtende blød kontaktlinse, der forsyner tårer via elektroosmotisk strømning fra det midlertidige tårereservoir bag det nedre øjenlåg. Kredit:Tohoku University Forskere ved
Selvfugtende smarte kontaktlinserIllustration af en selvfugtende blød kontaktlinse, der forsyner tårer via elektroosmotisk strømning fra det midlertidige tårereservoir bag det nedre øjenlåg. Kredit:Tohoku University Forskere ved -
 Annotationsværktøj giver et skridt i retning af at forstå sammenhænge mellem sygdom, mutant RNADette er en computergrafik af et RNA-molekyle. Kredit:Richard Feldmann/Wikipedia Forskere ved Oregon State University har udviklet et computerprogram, der repræsenterer et vigtigt skridt mod bedre
Annotationsværktøj giver et skridt i retning af at forstå sammenhænge mellem sygdom, mutant RNADette er en computergrafik af et RNA-molekyle. Kredit:Richard Feldmann/Wikipedia Forskere ved Oregon State University har udviklet et computerprogram, der repræsenterer et vigtigt skridt mod bedre -
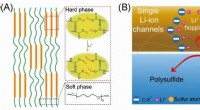 Stabiliserende svovlkatode med enkelt Li-ion-kanal polymerbindemiddel(A) Skematiske diagrammer over dannelsen af polymeren med enkeltionkanalerne. (B) Skematiske diagrammer af enkelt-ion-kanaler regulerer polysulfid- og Li-ion-hopningen. Kredit:©Science China Press
Stabiliserende svovlkatode med enkelt Li-ion-kanal polymerbindemiddel(A) Skematiske diagrammer over dannelsen af polymeren med enkeltionkanalerne. (B) Skematiske diagrammer af enkelt-ion-kanaler regulerer polysulfid- og Li-ion-hopningen. Kredit:©Science China Press -
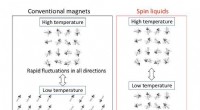 Fra rigelige kulbrinter til sjældne spinvæskerFig. 1 Forskelle mellem almindelige magneter og centrifugeringsvæsker. Ved høje temperaturer, spinnene - de små kompasser for hver uparret elektron i materialerne - svinger tilfældigt mellem vilkårlig
Fra rigelige kulbrinter til sjældne spinvæskerFig. 1 Forskelle mellem almindelige magneter og centrifugeringsvæsker. Ved høje temperaturer, spinnene - de små kompasser for hver uparret elektron i materialerne - svinger tilfældigt mellem vilkårlig
- Sådan fungerer Voynich -manuskriptet
- Bærbar enhed belyser vejen til bedre opdagelse af fødevarebårne sygdomme
- San Franciscos anklagere henvender sig til kunstig intelligens for at reducere racemæssig skævhed
- At se hele galaksen med et andet øje på himlen
- Når aluminium overstråler guld:Undersøg detaljer om aluminiums værdifulde plasmoniske egenskaber
- Lever glade mennesker længere liv?


