Hvor mange elektroner skulle kulstof få en kovalent binding?
* Carbon's elektroniske konfiguration: Carbon har 6 elektroner. Dens elektroniske konfiguration er 1S² 2S²2p². Det har 4 elektroner i sin yderste skal (2S²2p²).
* Octet -reglen: Atomer har en tendens til at vinde, miste eller dele elektroner for at opnå en stabil konfiguration med 8 elektroner i deres yderste skal (oktetreglen).
* kovalent binding: Carbon opnår denne stabilitet ved at dele sine 4 valenselektroner med andre atomer og danner fire kovalente bindinger.
Eksempel: I metan (CH₄) deler carbon sine fire valenselektroner med fire hydrogenatomer, der danner fire enkelt kovalente bindinger. Hvert hydrogenatom bidrager med et elektron til det delte par, der afslutter Carbon's Octet.
Sidste artikelHvad er den kemiske sammensætning af tartrat?
Næste artikelHvad er formålet med forbindelser?
 Varme artikler
Varme artikler
-
 Forskning peger på unikke lægemiddelmål i antibiotikaresistente bakterierNye ideer er tvingende nødvendige for udvikling af antibiotika. Kredit:Shutterstock Forskere har identificeret en kritisk mekanisme, der gør det muligt for dødelige bakterier at blive modstandsdyg
Forskning peger på unikke lægemiddelmål i antibiotikaresistente bakterierNye ideer er tvingende nødvendige for udvikling af antibiotika. Kredit:Shutterstock Forskere har identificeret en kritisk mekanisme, der gør det muligt for dødelige bakterier at blive modstandsdyg -
 En reaktion ved anvendelse af lys og to overgangsmetal-katalysatorer til fremstilling af anilinerKredit:Unsplash/CC0 Public Domain Et team af forskere fra University of Manchester og lægemiddelvirksomheden AstraZeneca har udviklet en reaktion, der bruger lys og to overgangsmetalkatalysatorer
En reaktion ved anvendelse af lys og to overgangsmetal-katalysatorer til fremstilling af anilinerKredit:Unsplash/CC0 Public Domain Et team af forskere fra University of Manchester og lægemiddelvirksomheden AstraZeneca har udviklet en reaktion, der bruger lys og to overgangsmetalkatalysatorer -
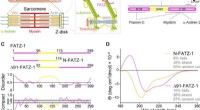 Bestil fra uorden i sarkomerenProteiner fra FATZ-familien viser iboende lidelse. (A) Skema af den tværstribede muskelsarkomer og nærbillede af F-actin/α-actinin/FATZ interaktioner i Z-disk. (B) Skema af FATZ-1-interaktomet og bind
Bestil fra uorden i sarkomerenProteiner fra FATZ-familien viser iboende lidelse. (A) Skema af den tværstribede muskelsarkomer og nærbillede af F-actin/α-actinin/FATZ interaktioner i Z-disk. (B) Skema af FATZ-1-interaktomet og bind -
 Første fleksible hukommelsesenhed, der bruger oxid ferroelektrisk materialeKredit:North Carolina State University For første gang, forskere har været i stand til at afsætte en ultratynd oxid ferroelektrisk film på et fleksibelt polymersubstrat. Forskerholdet brugte de fl
Første fleksible hukommelsesenhed, der bruger oxid ferroelektrisk materialeKredit:North Carolina State University For første gang, forskere har været i stand til at afsætte en ultratynd oxid ferroelektrisk film på et fleksibelt polymersubstrat. Forskerholdet brugte de fl


