Forskning peger på unikke lægemiddelmål i antibiotikaresistente bakterier

Nye ideer er tvingende nødvendige for udvikling af antibiotika. Kredit:Shutterstock
Forskere har identificeret en kritisk mekanisme, der gør det muligt for dødelige bakterier at blive modstandsdygtige over for antibiotika.
Resultaterne tilbyder et potentielt nyt lægemiddelmål i søgningen efter effektive nye antibiotika, da vi står over for den voksende trussel om antimikrobiel resistens (AMR) og infektioner forårsaget af bakterielle patogener.
Undersøgelsen undersøgte quinolonantibiotika, som bruges til at behandle en række bakterielle infektioner, herunder TB (tuberkulose). Quinoloner virker ved at hæmme bakterielle enzymer, gyrase og topoisomerase IV, derved forhindrer DNA-replikation og RNA-syntese afgørende for vækst.
De er meget vellykkede antimikrobielle midler, der er meget udbredt i den nuværende medicin, dog er bakteriel resistens over for dem og andre behandlinger et alvorligt problem.
Tidligere undersøgelser havde identificeret en resistensmekanisme forårsaget af produktionen af pentapeptid-gentagelsesproteiner (PRP'er), en familie af molekyler, der også fungerer som DNA-gyrase-hæmmere.
En af disse, kaldet MfpA, bibringer quinolonresistens over for Mycobacterium tuberculosis, det forårsagende middel til TB.
I dette studie forsøgte John Innes Center-forskere i gruppen af professor Tony Maxwell at opdage, hvordan PRP'er som MfpA, arbejde på molekylært niveau.
De rensede MfpA fra Mycobacterium smegmatis, en nær slægtning til M. tuberculosis, og viste, at det kan hæmme supercoiling-reaktionen af DNA-gyrase, målet for quinoloner i TB, der forårsager mykobakterier.
Yderligere undersøgelser viste, at MfpA kan forhindre forgiftning af gyrase med quinoloner, dermed beskytter den bakterielle værtscelle mod antibiotika.
Ved hjælp af røntgenkrystallografi, forskerne viste, at MfpA binder til ATPase-domænet af gyrase, og at dette forklarer dens evne til både at hæmme supercoiling-reaktionen og forhindre quinolonforgiftning.
"Vi forventede ikke, at den nøjagtige mekanisme af MfpA var at forhindre DNA-binding til gyrase ATPase-domænet; dette er en unik virkemåde, " sagde professor Tony Maxwell, tilsvarende forfatter til undersøgelsen.
"Vi tror på, at denne forståelse vil hjælpe med at drive nye ideer til udvikling af antibiotika blandt akademikere og forskere i medicinalindustrien, " han tilføjede.
Yderligere undersøgelsesarbejde vil involvere molekylær modellering baseret på MfpA-gyrase-strukturen for at designe små molekyler, der kunne efterligne denne interaktion og give mere indsigt i, hvordan det virker.
Undersøgelsen "Pentapeptid-gentag protein, MfpA, interagerer med mykobakteriel DNA-gyrase som en DNA T-segment-mimik" vises i PNAS .
 Varme artikler
Varme artikler
-
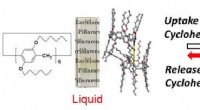 Damp driver en væske -fast overgang i et molekylært systemFigur 1. Skematisk illustration af cyclohexan gæstedampinduceret tilstandsændring af søjle [6] arene med 12 n-hexylgrupper. Kredit:Kanazawa University Den reversible omskiftning af makrocykliske m
Damp driver en væske -fast overgang i et molekylært systemFigur 1. Skematisk illustration af cyclohexan gæstedampinduceret tilstandsændring af søjle [6] arene med 12 n-hexylgrupper. Kredit:Kanazawa University Den reversible omskiftning af makrocykliske m -
 Din solcreme forurener måske havet – men alger kan være et naturligt alternativKredit:Shutterstock Anslået 6, 000-14, 000 tons solcreme deponeres hvert år i havets koralrevområder. De kemikalier, vi gnider på vores hud, kan hjælpe med at forhindre hudkræft, men vi er kun lig
Din solcreme forurener måske havet – men alger kan være et naturligt alternativKredit:Shutterstock Anslået 6, 000-14, 000 tons solcreme deponeres hvert år i havets koralrevområder. De kemikalier, vi gnider på vores hud, kan hjælpe med at forhindre hudkræft, men vi er kun lig -
 Forskere udvikler ultrahøjtydende plasmoniske metaloxidmaterialerKredit:CC0 Public Domain I en undersøgelse offentliggjort i Avancerede materialer , forskere fra Hefei National Laboratory for Physical Sciences på Microscale, University of Science and Technolo
Forskere udvikler ultrahøjtydende plasmoniske metaloxidmaterialerKredit:CC0 Public Domain I en undersøgelse offentliggjort i Avancerede materialer , forskere fra Hefei National Laboratory for Physical Sciences på Microscale, University of Science and Technolo -
 Identifikation af designermedicin taget af overdosispatienterLægemidler frigivet fra testpatronen (i midten) identificeres af et massespektrometer (venstre). Kredit:Greta Ren Overdosering af stoffer tager en enorm vejafgift på folkesundheden, med potente sy
Identifikation af designermedicin taget af overdosispatienterLægemidler frigivet fra testpatronen (i midten) identificeres af et massespektrometer (venstre). Kredit:Greta Ren Overdosering af stoffer tager en enorm vejafgift på folkesundheden, med potente sy


