Hvad er opløseligheden af et metal?
Metaller og opløselighed:
* Metaller er generelt uopløselige i vand: De fleste metaller opløses ikke i vand under normale forhold. Dette skyldes, at de metalliske bindinger inden for metallet er meget stærke, og vandmolekyler har ikke nok energi til at bryde dem fra hinanden.
* Opløsning i syrer: Nogle metaller kan opløses i syrer, såsom saltsyre (HCI) eller svovlsyre (H₂so₄). Dette skyldes, at syren kan reagere med metallet og danne metalioner, der går i opløsning. For eksempel reagerer jern (Fe) med saltsyre for at danne jern (II) -ioner (Fe²⁺) og brintgas (H₂).
* amalgamation: Nogle metaller, som guld (AU) og sølv (AG), kan opløses i kviksølv (HG) for at danne en legering kaldet et amalgam. Denne proces handler mere om en fysisk blanding end en kemisk reaktion, men den "opløses" metallerne inden for kviksølvet.
* Elektrokemiske reaktioner: I nogle elektrokemiske reaktioner kan metaller opløses gennem oxidationsprocesser. Dette involverer tab af elektroner fra metalatomerne, hvilket fører til dannelse af metalioner i opløsning.
nøglepunkter at huske:
* Opløseligheden af et metal afhænger stærkt af det specifikke metal og det anvendte opløsningsmiddel.
* Opløselighed påvirkes ofte af temperatur, tryk og tilstedeværelsen af andre kemikalier.
* Det er vigtigt at bemærke, at opløsning af et metal ikke altid betyder, at det virkelig er opløst på et molekylært niveau. Det kan involvere reaktioner, der danner nye forbindelser eller legeringer.
Derfor, når man taler om opløseligheden af et metal, er det vigtigt at specificere opløsningsmidlet og betingelserne, under hvilke opløsningen finder sted.
 Varme artikler
Varme artikler
-
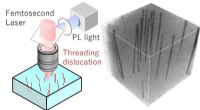 Ikke -destruktiv karakteriseringsteknik hjælper udviklingen af galliumnitridkrystalFig. 1. Målesystem og observationsbillede af TDer i GaN -halvleder ved fotoluminescensmetode med multiphoton -excitation. TDer observeres som mørke linjer. Kredit:Osaka University Fig. 1. Målesystem o
Ikke -destruktiv karakteriseringsteknik hjælper udviklingen af galliumnitridkrystalFig. 1. Målesystem og observationsbillede af TDer i GaN -halvleder ved fotoluminescensmetode med multiphoton -excitation. TDer observeres som mørke linjer. Kredit:Osaka University Fig. 1. Målesystem o -
 Æteriske oliekomponenter kan testes som lægemiddelkandidaterKredit:CC0 Public Domain Et forskerhold ved VIB-KU Leuven Center for Mikrobiologi og KU Leuven Biologisk Institut viste, at i modsætning til almindelig tro, de fleste komponenter i æteriske olier
Æteriske oliekomponenter kan testes som lægemiddelkandidaterKredit:CC0 Public Domain Et forskerhold ved VIB-KU Leuven Center for Mikrobiologi og KU Leuven Biologisk Institut viste, at i modsætning til almindelig tro, de fleste komponenter i æteriske olier -
 Røget mad er mere velsmagende, mindre skadeligt med et tip fra bilindustrienKredit:CC0 Public Domain Infusion af fødevarer med røg kan give lækre nuancerede smage, men kan også komme med en uvelkommen side af kræftfremkaldende stoffer. For at reducere kræftfremkaldende in
Røget mad er mere velsmagende, mindre skadeligt med et tip fra bilindustrienKredit:CC0 Public Domain Infusion af fødevarer med røg kan give lækre nuancerede smage, men kan også komme med en uvelkommen side af kræftfremkaldende stoffer. For at reducere kræftfremkaldende in -
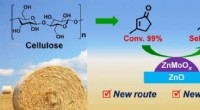 Forskere syntetiserer bio-baseret methylcyclopentadien med 3-methylcyclopent-2-enonDirekte hydrodeoxygenering af MCP til MCPD på den delvist reducerede Zn-Mo-oxidkatalysator. Kredit:DICP Methylcyclopentadien (MCPD) er en vigtig monomer i produktionen af RJ-4 brændstof, et rake
Forskere syntetiserer bio-baseret methylcyclopentadien med 3-methylcyclopent-2-enonDirekte hydrodeoxygenering af MCP til MCPD på den delvist reducerede Zn-Mo-oxidkatalysator. Kredit:DICP Methylcyclopentadien (MCPD) er en vigtig monomer i produktionen af RJ-4 brændstof, et rake
- Hvordan jagten på en skalerbar kvantecomputer hjælper med at bekæmpe kræft
- Sådan beregnes beløb pr. Kvadratfod
- Billede:Proba-1 billeder Calanda reservoir
- Sådan laver du en solvarmer ved hjælp af en sodavand
- Hvilken planet ser ud til at være blågrøn i teleskopet?
- Hvad vil blanding af CFC-12 og HFC-134a i det samme system?


