Hvad er den molekylære formel for et stof, der har en empirisk C2H5 og masse 58 gram pr. Mol?
1. Beregn den empiriske formelmasse:
* Carbon (c):2 atomer * 12,01 g/mol =24,02 g/mol
* Hydrogen (H):5 atomer * 1,01 g/mol =5,05 g/mol
* Samlet empirisk formelmasse:24,02 + 5,05 =29,07 g/mol
2. Bestem forholdet mellem molekylmassen og empirisk formelmasse:
* Molekylær masse / empirisk formelmasse =58 g / mol / 29,07 g / mol ≈ 2
3. Multiplicer underskrifterne i den empiriske formel med forholdet:
* C₂h₅ * 2 = c₄h₁₀
Derfor er stoffets molekylære formel c₄h₁₀.
Sidste artikelHvilket metal er ikke reaktivt med saltsyre?
Næste artikelHvad kaldes det, når og protonerne er forskellige?
 Varme artikler
Varme artikler
-
 Motion er godt for din hud:Et protein efterligner nogle antialdringseffekter hos musForskere forstår endnu ikke virkningerne af aldring på de cellulære processer, der er involveret i hudheling. Justin Crane, en assisterende professor i biologi på Northeastern, og Wesley Wong, en fjer
Motion er godt for din hud:Et protein efterligner nogle antialdringseffekter hos musForskere forstår endnu ikke virkningerne af aldring på de cellulære processer, der er involveret i hudheling. Justin Crane, en assisterende professor i biologi på Northeastern, og Wesley Wong, en fjer -
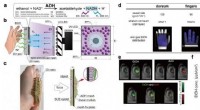 At se det usynlige – Et nyt gasbilleddannelsessystem(a) Detektionsprincip for EtOH baseret på den ADH-medierede katalytiske reaktion. (b) Skematisk diagram af skin-gas-kammen. (c) Arbejdsmekanisme af todimensionel (2D) Mako. (d) Sammenfatning af svedha
At se det usynlige – Et nyt gasbilleddannelsessystem(a) Detektionsprincip for EtOH baseret på den ADH-medierede katalytiske reaktion. (b) Skematisk diagram af skin-gas-kammen. (c) Arbejdsmekanisme af todimensionel (2D) Mako. (d) Sammenfatning af svedha -
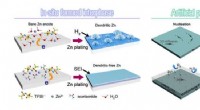 Grænsefladekemi forbedrer genopladeligheden af Zn-batterierIn situ dannede og kunstige beskyttende interfaser for at tæmme Zn elektrokemi. Kredit:ZHAO Jingwen, ZHAO Zhiming og QIU Huayu Med stor interesse for miljøvenlig og effektiv ressourceudnyttelse, g
Grænsefladekemi forbedrer genopladeligheden af Zn-batterierIn situ dannede og kunstige beskyttende interfaser for at tæmme Zn elektrokemi. Kredit:ZHAO Jingwen, ZHAO Zhiming og QIU Huayu Med stor interesse for miljøvenlig og effektiv ressourceudnyttelse, g -
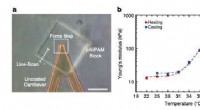 Forskere udvikler 3-D mikrostrukturer, der reagerer på temperatur og lysMekanisk analyse af en pNIPAM-blok fremstillet ved 3D-laserlitografi. a) Optisk mikrofotografi i AFM med overlejrede indikationer for kraftmålingerne og linjescanningen. Skalaen er 50 µm. b) Målt Youn
Forskere udvikler 3-D mikrostrukturer, der reagerer på temperatur og lysMekanisk analyse af en pNIPAM-blok fremstillet ved 3D-laserlitografi. a) Optisk mikrofotografi i AFM med overlejrede indikationer for kraftmålingerne og linjescanningen. Skalaen er 50 µm. b) Målt Youn
- Hvad er den primære energikilde, der driver Jordens vandcyklus mellem atmosfære oceaner og jord?
- App konverterer luftafgrødebilleder til realtidsmålinger af plantevækst og afgrødesundhed
- Bakterier reproducerer normalt aseksuelt, men nogle gange udveksler de genetisk information under ko…
- NASA-finansieret websted lader offentlig søge efter nye nærliggende verdener
- Drivkraften bag tropiske mudderskred
- Hvad er fossile rig kalksten?


