Hvad er vandige løsninger, og hvorfor de tiltrukket af anioner?
vandige løsninger
* hvad de er: Vandige opløsninger er simpelthen blandinger, hvor et stof (opløst) opløses i vand (opløsningsmiddel). Tænk på sukker i vand, salt i vand eller endda en lille smule syre eller base i vand.
* Hvorfor er de vigtige: Vand er et utroligt alsidigt opløsningsmiddel, der muliggør en lang række kemiske reaktioner og biologiske processer.
Interaktioner med ioner
* ioner: Ioner er atomer eller molekyler, der har opnået eller mistet elektroner, hvilket giver dem en netto elektrisk ladning. Positivt ladede ioner kaldes kationer (som Na+) og negativt ladede ioner kaldes anioner (som cl-).
* attraktion: Vandmolekyler er polære. Dette betyder, at de har en lidt positiv ende (nær hydrogenatomerne) og en lidt negativ ende (nær iltatomet). Denne polaritet giver vandmolekyler mulighed for at tiltrække og omgive ioner.
Sådan fungerer det:
1. Hydrering: Når en ionisk forbindelse (som salt, NaCl) opløses i vand, omgiver vandmolekylerne ionerne. De positive ender af vandmolekyler tiltrækkes af de negative anioner, og de negative ender af vandmolekyler tiltrækkes af de positive kationer. Denne proces kaldes hydrering .
2. dissociation: Tiltrækningen mellem vandmolekyler og ionerne er stærk nok til at overvinde kræfterne, der holder ionerne sammen i den faste krystal. Dette får den ioniske forbindelse til at dissociere (bryde fra hinanden) i dets individuelle ioner.
Vigtig note: Mens vand er polært og tiltrækker ioner, tiltrækker det ikke specifikt "anioner mere end kationer. Det tiltrækker begge dele, og hydratiseringsprocessen hjælper med at opløse den ioniske forbindelse som helhed.
Lad mig vide, om du gerne vil udforske nogen af disse koncepter mere detaljeret!
 Varme artikler
Varme artikler
-
 Galvanisering:Fødslen af en enkelt kerne fanget i kameraSkematisk af detektering af optisk feedback af de hydrodynamiske signaturer af nukleation. en lodret orienteret probe (VOP) scannet over de begyndende Cu -kerner på ITO -elektroden (grå). Den blå grad
Galvanisering:Fødslen af en enkelt kerne fanget i kameraSkematisk af detektering af optisk feedback af de hydrodynamiske signaturer af nukleation. en lodret orienteret probe (VOP) scannet over de begyndende Cu -kerner på ITO -elektroden (grå). Den blå grad -
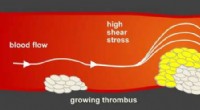 Antilock bremsesystem i arterier beskytter mod hjerteanfaldJo større blodprop, jo mindre plads har blodet til at flyde. Den øgede forskydningsspænding udløser en mekanisme, der naturligt hæmmer blodproppen. Kredit:Susanne Feil Tübingen biokemikere har opd
Antilock bremsesystem i arterier beskytter mod hjerteanfaldJo større blodprop, jo mindre plads har blodet til at flyde. Den øgede forskydningsspænding udløser en mekanisme, der naturligt hæmmer blodproppen. Kredit:Susanne Feil Tübingen biokemikere har opd -
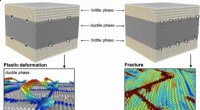 Foreslået ingeniørmetode kunne bidrage til at gøre bygninger og broer sikrereGrænseflade-dislokationskontrolleret deformation og fraktur i nanolagskompositter. Afstanden mellem grænsefladeforskydninger, som optager misfit-belastning mellem ferrit- og cementitfasen, bestemmer f
Foreslået ingeniørmetode kunne bidrage til at gøre bygninger og broer sikrereGrænseflade-dislokationskontrolleret deformation og fraktur i nanolagskompositter. Afstanden mellem grænsefladeforskydninger, som optager misfit-belastning mellem ferrit- og cementitfasen, bestemmer f -
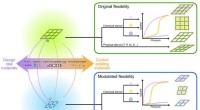 Mod design/styring af fleksibilitet af MOF'erFleksible metal-organiske rammer:fra at kontrollere konstruktionerne til at kontrollere fleksibiliteten. Kredit:Science China Press Porøse koordineringspolymerer (PCPer) eller metal-organiske ramm
Mod design/styring af fleksibilitet af MOF'erFleksible metal-organiske rammer:fra at kontrollere konstruktionerne til at kontrollere fleksibiliteten. Kredit:Science China Press Porøse koordineringspolymerer (PCPer) eller metal-organiske ramm
- Hvad er cellerne opbevaret i æggestokke?
- Ingeniører udvikler innovative softwareværktøjer til mikrobiomanalyse
- Dommer bedt om at løfte fat i Yellowstone-dæmningen og beskytte fisk
- Mange flere bakterier har elektrisk ledende filamenter
- Sådan forvandles en negativ nævner til en Positive
- Organisk opløsningsmiddelsystem kan forbedre katalysatorgenanvendelse og skabe nye nanomedicinske a…


