Hvordan er en mest sandsynlig oxidationstilstand relateret til dens valenselektroner?
* Valenselektroner: Dette er elektronerne i den yderste skal af et atom. Det er dem, der er involveret i kemisk binding, og bestemmer elementets reaktivitet.
* Oxidationstilstand: Dette repræsenterer den hypotetiske ladning, som et atom ville have, hvis alle dens bindinger var 100% ioniske.
Forholdet:
1. Metaller: Metaller har en tendens til at miste deres valenselektroner for at opnå en stabil, ædelgaskonfiguration. Den mest sandsynlige oxidationstilstand for et metal er normalt lig med antallet af valenselektroner, det har. For eksempel:
* Natrium (NA) har 1 valenselektron og har typisk en oxidationstilstand på +1.
* Magnesium (Mg) har 2 valenselektroner og har typisk en oxidationstilstand på +2.
* Aluminium (AL) har 3 valenselektroner og har typisk en oxidationstilstand på +3.
2. ikke -metaller: Ikke -metaller har en tendens til at få elektroner for at opnå en stabil, ædelgaskonfiguration. Den mest sandsynlige oxidationstilstand for en ikke -metal er normalt lig med antallet af elektroner, den har brug for at få for at fuldføre sin ydre skal. For eksempel:
* Oxygen (O) har 6 valenselektroner og har typisk en oxidationstilstand på -2.
* Chlor (CL) har 7 valenselektroner og har typisk en oxidationstilstand på -1.
Undtagelser:
Der er undtagelser fra disse generelle tendenser. Nogle elementer kan udvise flere oxidationstilstande afhængigt af forbindelsen, de er i. Dette skyldes faktorer som:
* Elektronegativitet: Et atoms evne til at tiltrække elektroner. Flere elektronegative atomer har en tendens til at have flere negative oxidationstilstande.
* binding: Typen af binding (ionisk, kovalent) kan påvirke den oxidationstilstand, der er tildelt et atom.
* Overgangsmetaller: Overgangsmetaller har ofte flere oxidationstilstande på grund af tilgængeligheden af D-elektroner til binding.
Nøglepunkt: Mens der er undtagelser, giver antallet af valenselektroner et godt udgangspunkt for at forudsige den mest sandsynlige oxidationstilstand for et element.
Sidste artikelHvordan identificerer du, om det ukendte kemikalie er element eller forbindelser?
Næste artikelHvad komponerer atomer?
 Varme artikler
Varme artikler
-
 Splashdown:Supersonisk kold metalbinding i 3DCold Gas Dynamic Spray (CGDS)-processen bruges allerede til fremstilling af flydele og andre sarte overflader. Imidlertid er hele CGDS-processen fra flyvezone til partikelaflejringszone meget svær at
Splashdown:Supersonisk kold metalbinding i 3DCold Gas Dynamic Spray (CGDS)-processen bruges allerede til fremstilling af flydele og andre sarte overflader. Imidlertid er hele CGDS-processen fra flyvezone til partikelaflejringszone meget svær at -
 Forskere genbruger mislykket kræftlægemiddel til printbar halvlederKemisk og biomolekylær ingeniørprofessor Ying Diao og samarbejdspartnere har omdannet et mislykket kræftlægemiddel til en ny type organisk halvleder til brug i transistorer og kemiske sensorer. Kredit
Forskere genbruger mislykket kræftlægemiddel til printbar halvlederKemisk og biomolekylær ingeniørprofessor Ying Diao og samarbejdspartnere har omdannet et mislykket kræftlægemiddel til en ny type organisk halvleder til brug i transistorer og kemiske sensorer. Kredit -
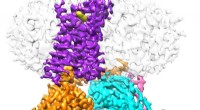 Se dopaminreceptorer i deres oprindelige levestedCryo-EM struktur af D2 dopaminreceptoren bundet til dets G-protein. Kredit:UT Southwestern Medical Center Dopamin, et kemikalie, der sender beskeder mellem forskellige dele af hjernen og kroppen,
Se dopaminreceptorer i deres oprindelige levestedCryo-EM struktur af D2 dopaminreceptoren bundet til dets G-protein. Kredit:UT Southwestern Medical Center Dopamin, et kemikalie, der sender beskeder mellem forskellige dele af hjernen og kroppen, -
 Ny undersøgelse ser på biologiske enzymer som kilde til brintbrændstofKemiprofessor Thomas Rauchfuss og samarbejdspartnere søger biologiske processer for at finde en effektiv kilde til brintgas som et miljøvenligt brændstof. Kredit:Fred Zwicky Forskning fra Universi
Ny undersøgelse ser på biologiske enzymer som kilde til brintbrændstofKemiprofessor Thomas Rauchfuss og samarbejdspartnere søger biologiske processer for at finde en effektiv kilde til brintgas som et miljøvenligt brændstof. Kredit:Fred Zwicky Forskning fra Universi
- Er økologisk landbrug altid godt for miljøet? Forskere laver strategi for at hjælpe med at bestem…
- Hvad er det levende materiale i en celle?
- Hvem opfandt serien kredsløb?
- Et nyt kapitel i druedyrkning:Ikke-transgen plantegendannelsesteknologi
- Hvad er 100 7 i Celsius?
- NOAAs GOES-16 er klar til at forbedre prognoserne endnu mere


