Er smeltepunktet for bromer højere eller lavere end klor?
Her er hvorfor:
* Intermolekylære kræfter: Brom (Br₂) og chlor (CL₂) er begge diatomiske halogener. De oplever van der Waals -styrker, specifikt London -spredningskræfter. Disse kræfter stammer fra midlertidige udsving i elektronfordeling og skaber midlertidige dipoler.
* størrelse og polariserbarhed: Bromatomer er større end kloratomer. Større atomer har en større elektronsky, hvilket gør dem mere polariserbare. Dette betyder, at midlertidige dipoler er stærkere og lettere at danne i brom sammenlignet med klor.
* stærkere intermolekylære kræfter: Stærkere London -spredningskræfter i brom resulterer i et højere smeltepunkt, fordi der er behov for mere energi for at overvinde disse kræfter og bryde de intermolekylære bindinger.
smeltepunkter:
* Klor (Cl₂):-101,5 ° C
* Brom (Br₂):-7,2 ° C
Sidste artikelHvad bliver solidt over smeltepunktet?
Næste artikelHvor mange mol Mg er 2,01 gange 10x22 atomer?
 Varme artikler
Varme artikler
-
 Oprettelse af mRNA med en helt kemisk proces kan give mulighed for tilpassede mRNA-vaccinermRNA med sin glødende hætte. Kredit:Reiko Matsushita Forskere ved Nagoya University i Japan har udviklet en ny kemisk proces, der kan repræsentere et vigtigt gennembrud i at skabe skræddersyede mRN
Oprettelse af mRNA med en helt kemisk proces kan give mulighed for tilpassede mRNA-vaccinermRNA med sin glødende hætte. Kredit:Reiko Matsushita Forskere ved Nagoya University i Japan har udviklet en ny kemisk proces, der kan repræsentere et vigtigt gennembrud i at skabe skræddersyede mRN -
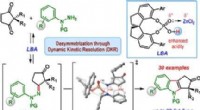 Enantioselektiv syntese af indolderivaterKredit:Wiley Indoler, og strukturer afledt af dem, er en del af mange naturlige stoffer, såsom aminosyren tryptofan. En ny katalytisk reaktion producerer cyclopenta[ b ] indoler - rammer lavet af
Enantioselektiv syntese af indolderivaterKredit:Wiley Indoler, og strukturer afledt af dem, er en del af mange naturlige stoffer, såsom aminosyren tryptofan. En ny katalytisk reaktion producerer cyclopenta[ b ] indoler - rammer lavet af -
 Hurtig og let syntese af antibakteriel aminosyre Schiff-base kobberkomplekserForskere fra Tokyo University of Science brugte en to-trins mikrobølgebestrålingsteknik til at syntetisere aminosyre Schiff base Cu (II) komplekser inden for 10 minutter. De fremstillede baser udviste
Hurtig og let syntese af antibakteriel aminosyre Schiff-base kobberkomplekserForskere fra Tokyo University of Science brugte en to-trins mikrobølgebestrålingsteknik til at syntetisere aminosyre Schiff base Cu (II) komplekser inden for 10 minutter. De fremstillede baser udviste -
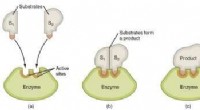 Ændring af perspektivet på oprindelsen af enzymatisk katalytisk kraftGrafisk fremstilling af trinene i en enzymatisk reaktion. Kredit:Wikimedia Commons De enzymer, der findes i levende organismer, har en imponerende katalytisk kraft. Takket være enzymer sker de kemi
Ændring af perspektivet på oprindelsen af enzymatisk katalytisk kraftGrafisk fremstilling af trinene i en enzymatisk reaktion. Kredit:Wikimedia Commons De enzymer, der findes i levende organismer, har en imponerende katalytisk kraft. Takket være enzymer sker de kemi
- Hvorfor er gæringsreaktioner vigtige for celler?
- Nye beviser afslører kilden til 1586 Sanriku, Japan tsunami
- Kvasi-partikler med afstembare interaktioner
- Hvorfor har Storbritannien så mange accenter?
- Genetisk undersøgelse af forhistorisk pige:Dating og DNA viser palæoamerikansk-indianer-forbindels…
- Kunne mørkt stof ikke betyde noget?


