Hvad er betydningen af en elektronegativitetsforskel mellem 1,7 og 2 atomer?
* Elektronegativitet: Denne egenskab måler en atoms evne til at tiltrække elektroner i en kemisk binding. Jo højere elektronegativitet, jo stærkere er trækket på delte elektroner.
* obligationstyper:
* ikke -polær kovalent: Når to atomer har lignende elektronegativiteter, deler de elektroner temmelig lige, hvilket resulterer i en ikke -polær binding.
* polær kovalent: Når der er forskel i elektronegativitet, tiltrækker atomet med højere elektronegativitet de delte elektroner stærkere. Dette skaber en delvis negativ ladning (Δ-) på dette atom og en delvis positiv ladning (Δ+) på det andet atom. Denne ujævne elektronfordeling skaber en polær binding .
* ionisk: Når elektronegativitetsforskellen er stor (typisk større end 2,0), stjæler den mere elektronegative atom i det væsentlige elektronet fra det andet atom, hvilket skaber ioner og en ionisk binding.
* Betydning:
* Polaritet: Polære kovalente bindinger fører til polære molekyler, som har en positiv og negativ ende. Denne polaritet er afgørende for mange kemiske interaktioner, herunder:
* opløselighed: Polære molekyler har en tendens til at opløses i polære opløsningsmidler (som vand), mens ikke -polære molekyler opløses i ikke -polære opløsningsmidler (som olie).
* Intermolekylære kræfter: Polære molekyler har stærkere intermolekylære kræfter end ikke -polære molekyler, hvilket fører til højere smeltepunkter og kogepunkter.
* Kemisk reaktivitet: Polære molekyler kan indgå i forskellige kemiske reaktioner end ikke -polære molekyler.
Eksempler:
* H-CL: Elektronegativitetsforskel ≈ 0,9 (polær kovalent binding)
* C-O: Elektronegativitetsforskel ≈ 1.0 (Polar Covalent Bond)
* NA-CL: Elektronegativitetsforskel ≈ 2.1 (ionisk binding)
I resuméet En elektronegativitetsforskel mellem 1,7 og 2,0 indikerer en binding, hvor elektroner deles ulige, hvilket skaber en polær kovalent binding. Denne polaritet har betydelige konsekvenser for egenskaberne og reaktiviteten af det resulterende molekyle.
Sidste artikelEr smeltning af en fed kemisk ændring?
Næste artikelHvor mange elektroner er der i BR-80?
 Varme artikler
Varme artikler
-
 Hydrogenalarm til fjernbetjening af hydrogenlækageKredit:Tomsk Polytechnic University Brint betragtes som en af de lovende alternative energikilder. Alligevel, dets anvendelse som energibærer er kompliceret på grund af dets stærkt eksplosive na
Hydrogenalarm til fjernbetjening af hydrogenlækageKredit:Tomsk Polytechnic University Brint betragtes som en af de lovende alternative energikilder. Alligevel, dets anvendelse som energibærer er kompliceret på grund af dets stærkt eksplosive na -
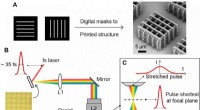 Ny teknik øger 3D-printhastigheden med 1, 000 til 10, 000 gangeFP-TPL baseret på rumlig og tidsmæssig fokusering. Kredit:CUHK Ultrapræcis 3-D printteknologi er en nøglemulighed for fremstilling af præcisionsbiomedicinske og fotoniske enheder. Imidlertid, den
Ny teknik øger 3D-printhastigheden med 1, 000 til 10, 000 gangeFP-TPL baseret på rumlig og tidsmæssig fokusering. Kredit:CUHK Ultrapræcis 3-D printteknologi er en nøglemulighed for fremstilling af præcisionsbiomedicinske og fotoniske enheder. Imidlertid, den -
 Forskere udvikler syntetiske stilladser til at helbrede skadede sener og ledbåndForskningen håber at forbedre resultaterne af sportsskadeoperationer. Kredit:Pixabay Australiens kærlighed til sport betyder, at det har en af de højeste forekomster af forreste korsbånd (ACL) s
Forskere udvikler syntetiske stilladser til at helbrede skadede sener og ledbåndForskningen håber at forbedre resultaterne af sportsskadeoperationer. Kredit:Pixabay Australiens kærlighed til sport betyder, at det har en af de højeste forekomster af forreste korsbånd (ACL) s -
 Næste generations insektmidler til at bekæmpe myggebårne sygdommeAnopheles gambiae myg, lever af blod. Kredit:James Gathany, Centre for Disease Control and Prevention Næsten 700 millioner mennesker lider af myggebårne sygdomme – såsom malaria, West Nile, Zika-
Næste generations insektmidler til at bekæmpe myggebårne sygdommeAnopheles gambiae myg, lever af blod. Kredit:James Gathany, Centre for Disease Control and Prevention Næsten 700 millioner mennesker lider af myggebårne sygdomme – såsom malaria, West Nile, Zika-
- Team løser gammelt mysterium, baner vej mod fremskridt inden for medicin, industri, Miljøvidenskab
- Hvordan tarmen erstatter og reparerer sig selv
- Hvad er vigtigheden af propan?
- Hvad er accelerationen af en lastbil med masse 2000 kg, når dens bremser anvender kraft 10000 N?
- Hvilke elementer er der i lyspærer?
- AI kan nu læse følelser - men skal det?


