Misser eller GAI elektroner under kemisk reaktion?
Her er hvorfor:
* Elektronkonfiguration: Gruppe 13A -elementer har tre valenselektroner (elektroner i deres yderste skal). De ønsker at opnå en stabil octet -konfiguration (otte elektroner i den yderste skal), som er det mest stabile arrangement for atomer.
* ioniseringsenergi: Gruppe 13A -elementer har relativt lave ioniseringsenergier, hvilket betyder, at de ikke kræver meget energi for at fjerne en elektron.
* Dannelse af kationer: Ved at miste tre elektroner danner de kationer med en +3 ladning. Denne proces giver dem mulighed for at opnå en stabil oktetkonfiguration.
Eksempler:
* aluminium (AL) Mister let tre elektroner til dannelse af al³⁺ -ioner.
* bor (b) Kan også danne b³⁺ -ioner, men det er mindre almindeligt, da det er mindre og har en højere ioniseringsenergi.
Vigtig note:
Mens gruppe 13A -elementer typisk mister elektroner, kan de også deltage i kovalente binding ved at dele elektroner med andre atomer. Dette gælder især for bor, der ofte danner kovalente obligationer.
 Varme artikler
Varme artikler
-
 Polymer-afledt kulstof som metalfrit, grønt alternativ til katalysatorer og nanocarbonerKredit:CC0 Public Domain Katalysatorer er nøglematerialer i det moderne samfund, muliggør selektiv omdannelse af råvarer til værdifulde produkter, samtidig med at spild reduceres og energi spares.
Polymer-afledt kulstof som metalfrit, grønt alternativ til katalysatorer og nanocarbonerKredit:CC0 Public Domain Katalysatorer er nøglematerialer i det moderne samfund, muliggør selektiv omdannelse af råvarer til værdifulde produkter, samtidig med at spild reduceres og energi spares. -
 Spiselig belægning til konservering af havaborreFigur (A) viser et skematisk billede af processen involveret i behandlingen af fiskegelatine og vindruekerneekstrakt på havaborrefileter til undersøgelsen. (B) Plotterne viser (til venstre) bakterie
Spiselig belægning til konservering af havaborreFigur (A) viser et skematisk billede af processen involveret i behandlingen af fiskegelatine og vindruekerneekstrakt på havaborrefileter til undersøgelsen. (B) Plotterne viser (til venstre) bakterie -
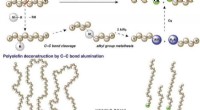 Plast kunne se et andet liv som biologisk nedbrydelige overfladeaktive stofferLange carbonhydridkæder af polymerer opdeles i kortere enheder med introduktionen af endegrupper af aluminium. Kredit:US Department of Energy, Ames Laboratorium Forskere ved Institute for Cooper
Plast kunne se et andet liv som biologisk nedbrydelige overfladeaktive stofferLange carbonhydridkæder af polymerer opdeles i kortere enheder med introduktionen af endegrupper af aluminium. Kredit:US Department of Energy, Ames Laboratorium Forskere ved Institute for Cooper -
 Tager Australiens hjemmedyrkede superfood mainstreamEt lupinfrø. Kredit:Edith Cowan University Lupiner har længe været udråbt som den næste superfood, bekæmpelse af hjertesygdomme, diabetes og fedme og ny forskning fra Edith Cowan University (ECU)
Tager Australiens hjemmedyrkede superfood mainstreamEt lupinfrø. Kredit:Edith Cowan University Lupiner har længe været udråbt som den næste superfood, bekæmpelse af hjertesygdomme, diabetes og fedme og ny forskning fra Edith Cowan University (ECU)


