Når kemisk binding opstår?
Drevet for stabilitet:
* octet regel: Atomer har en tendens til at vinde, miste eller dele elektroner for at opnå en fuld ydre skal af otte elektroner (undtagen for brint og helium, som kun har brug for to). Denne fulde ydre skal er meget stabil og gør atomet mindre reaktivt.
* Elektrostatiske interaktioner: Den positivt ladede kerne af et atom tiltrækker de negativt ladede elektroner fra andre atomer. Denne attraktion er grundlaget for kemisk binding.
Typer af kemisk binding:
* ionisk binding: Et atom overfører helt elektroner til en anden og skaber ioner med modsatte ladninger. Disse ioner holdes sammen af elektrostatiske kræfter. Eksempel:NaCl (natriumchlorid)
* kovalent binding: Atomer deler elektroner for at opnå en stabil konfiguration. Denne deling kan være ens (ikke -polær kovalent) eller ulig (polær kovalent), afhængigt af elektronegativitetsforskellen mellem atomerne. Eksempel:H₂O (vand)
* Metallisk binding: Valenselektroner delokaliseres og bevæger sig frit gennem et gitter af positivt ladede metalioner. Dette skaber en stærk, men alligevel fleksibel bånd. Eksempel:Kobber (CU)
Faktorer, der påvirker binding:
* Elektronegativitet: Et atomes evne til at tiltrække elektroner i en binding. Jo større forskellen i elektronegativitet mellem to atomer, desto mere sandsynligt er det, at de danner en ionisk binding.
* ioniseringsenergi: Den energi, der kræves for at fjerne et elektron fra et atom.
* Elektronaffinitet: Ændringen i energi, når et atom får en elektron.
Nøglepunkter:
* Kemisk binding er afgørende for dannelsen af alle stoffer, vi ser omkring os.
* Styrken og typen af kemiske bindinger bestemmer de fysiske og kemiske egenskaber ved molekyler og forbindelser.
Fortæl mig, hvis du vil udforske nogen af disse typer binding mere detaljeret!
 Varme artikler
Varme artikler
-
 Fange solen:Ny tyndfilmsteknologi bruger bæredygtige komponenter til solpanelerI umiddelbar nærhed af vores hjem og liv, solpaneler er de mest effektive, når de er billige og ikke-giftige. DGIST-teamet forberedte CZTSSe-solceller i laboratorieskala, og en af dem viste en uafgj
Fange solen:Ny tyndfilmsteknologi bruger bæredygtige komponenter til solpanelerI umiddelbar nærhed af vores hjem og liv, solpaneler er de mest effektive, når de er billige og ikke-giftige. DGIST-teamet forberedte CZTSSe-solceller i laboratorieskala, og en af dem viste en uafgj -
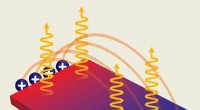 Exciplex-emission observeret over meget længere afstande end tidligere antaget muligtFigur 1:En langdistance-interaktion mellem elektroner (røde kugler) og huller (blå kugler) adskilt af en spacer giver anledning til exciplex-emission (orange kruseduller), der kunne bruges i effektive
Exciplex-emission observeret over meget længere afstande end tidligere antaget muligtFigur 1:En langdistance-interaktion mellem elektroner (røde kugler) og huller (blå kugler) adskilt af en spacer giver anledning til exciplex-emission (orange kruseduller), der kunne bruges i effektive -
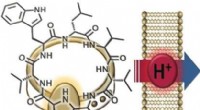 Kemisk syntese viser, at antibiotika fra den menneskelige næse virker ved protontranslokationKredit:Wiley Antibiotika-resistente bakterier er en stigende sundhedstrussel, gør nye antibiotika afgørende. Tyske forskere har for nylig haft et gennembrud:de opdagede lugdunin i den menneskelige
Kemisk syntese viser, at antibiotika fra den menneskelige næse virker ved protontranslokationKredit:Wiley Antibiotika-resistente bakterier er en stigende sundhedstrussel, gør nye antibiotika afgørende. Tyske forskere har for nylig haft et gennembrud:de opdagede lugdunin i den menneskelige -
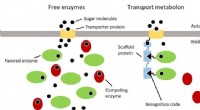 Mere effektiv udnyttelse af råmaterialer ved hjælp af molekylære transportbåndI bagegær, forskellige enzymer konkurrerer om sukkermolekyler, der indføres i cellen af transportproteiner. Således at sukkeret kun omdannes af enzymer, der leverer produkter, der er ønskelige fra e
Mere effektiv udnyttelse af råmaterialer ved hjælp af molekylære transportbåndI bagegær, forskellige enzymer konkurrerer om sukkermolekyler, der indføres i cellen af transportproteiner. Således at sukkeret kun omdannes af enzymer, der leverer produkter, der er ønskelige fra e
- Myreadfærd inspirerer til autonom materialesamlingsforskning
- Er tropopausen højest ved Nord- og Sydpolen?
- Solar Orbiter eksploderer for at fange det første kig på solens poler
- Hvad er en personvægt i det ydre rum, hvis de 637 Newton?
- Er det sandt, at kvinderne kommer fra Planet Venus?
- Hvad er køligere 12 Celsius eller Fahrenheit?


