Hvilket bidrag fra Niels Bohr til kemi?
* Forståelse af atomspektre: Bohr forklarede oprindelsen af linjespektre i atomer ved at foreslå, at elektroner kun kunne eksistere i specifikke energiniveauer (eller "skaller") omkring kernen. Når en elektron hopper mellem disse niveauer, absorberer eller udsender den energi i form af lys med en bestemt bølgelængde, hvilket resulterer i de observerede spektrale linjer. Dette forklarede fænomenet atomlinjespektre, der havde været et mysterium før Bohrs arbejde.
* Kvantisering af energi: Bohrs model introducerede konceptet med kvantiseret energiniveau i atomer, hvilket betyder, at elektroner kun kunne eksistere i specifikke diskrete energilater. Dette koncept var banebrydende, da det modsatte klassisk fysik, der forudsagde en kontinuerlig energifordeling for elektroner.
* Foundation for Quantum Chemistry: Bohrs arbejde gav en ramme for forståelse af elektronernes opførsel i atomer og banede vejen for udviklingen af kvantekemi. Kvantekemi bruger kvantemekanik til at undersøge egenskaberne ved molekyler og reaktioner, hvilket fører til udvikling af kraftfulde beregningsværktøjer til at forudsige kemisk opførsel og design af nye molekyler.
* Forklaring af kemisk binding: Mens Bohrs model senere blev erstattet af mere sofistikerede kvantemekaniske modeller, gav den stadig værdifuld indsigt i arten af kemisk binding. Det hjalp med at forklare, hvordan atomer delte elektroner til dannelse af kovalente bindinger, og hvordan arrangementet af elektroner i forskellige energiniveau påvirkede elementernes kemiske egenskaber.
Selvom Bohrs model havde begrænsninger og blev senere erstattet af mere sofistikerede modeller, lagde den grundlaget for forståelse af atomstruktur og de principper, der styrer kemisk opførsel. Hans arbejde revolutionerede vores forståelse af stof og gav det væsentlige grundlag for udviklingen af moderne kemi.
 Varme artikler
Varme artikler
-
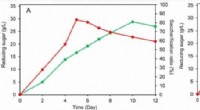 Ny konsolideret bio-saccharificeringsteknik til omdannelse af lignocellulose udvikletForsukring af forbehandlet hvedehalm under optimale eller regelmæssige forhold uden modifikation i både 100-ml anaerobe flasker (a) og en 10-L anaerob fermentor (b). Kredit:LIU Yajun En forskergru
Ny konsolideret bio-saccharificeringsteknik til omdannelse af lignocellulose udvikletForsukring af forbehandlet hvedehalm under optimale eller regelmæssige forhold uden modifikation i både 100-ml anaerobe flasker (a) og en 10-L anaerob fermentor (b). Kredit:LIU Yajun En forskergru -
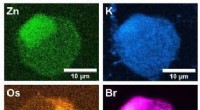 Forskere observerer, hvordan potentiel kræftbehandling reagerer i en enkelt celleRøntgenfluorescensbilleder taget ved I14-strålelinjen ved Diamond Light Source:Det grønne er zink, blå er kalium, orange er osmium og pink er brom. Kredit:University of Warwick Ved hjælp af en 185
Forskere observerer, hvordan potentiel kræftbehandling reagerer i en enkelt celleRøntgenfluorescensbilleder taget ved I14-strålelinjen ved Diamond Light Source:Det grønne er zink, blå er kalium, orange er osmium og pink er brom. Kredit:University of Warwick Ved hjælp af en 185 -
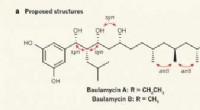 Kemikere udleder den korrekte struktur af A- og B-baulamycinerneTidligere foreslåede og faktiske molekylære strukturer af baulamycinerne. Kredit: Natur (2017). doi:10.1038/nature23265 (Phys.org) – Et team af kemikere ved University of Bristol har korrekt udle
Kemikere udleder den korrekte struktur af A- og B-baulamycinerneTidligere foreslåede og faktiske molekylære strukturer af baulamycinerne. Kredit: Natur (2017). doi:10.1038/nature23265 (Phys.org) – Et team af kemikere ved University of Bristol har korrekt udle -
 Forskere udvikler billige, høj strømtæthed vanadium flow batteri stakNy generation af vanadiumflow-batteristabelteknologi tilbyder lave omkostninger og høj effekttæthed. Kredit:SHI Dingqin Udviklingen af vedvarende energikilder såsom vind- og solenergi er begræns
Forskere udvikler billige, høj strømtæthed vanadium flow batteri stakNy generation af vanadiumflow-batteristabelteknologi tilbyder lave omkostninger og høj effekttæthed. Kredit:SHI Dingqin Udviklingen af vedvarende energikilder såsom vind- og solenergi er begræns
- Nye rammer tager højde for modstridende skøn over globale temperaturstigninger
- Europa ser ud til at genskabe internettet med nye regler om ophavsret
- Hvad er det maksimale antal hydrogenbindinger, der kan dannes i propylaminmolekyler og andre molekyl…
- Crinkle Crankle:The Serpentine Wall med et sjovt navn
- En liste over North Carolinas Natural Resources
- Ser tydeligt:Revideret computerkode modellerer nøjagtigt en ustabilitet i fusionsplasmaer


