Hvad sker der, når du blander en metalkation med ikke -metal anion?
1. Det grundlæggende:
* metalkationer: Metaller har en tendens til at miste elektroner og blive positivt ladede ioner (kationer).
* ikke -metalanioner: Ikke -metaller har en tendens til at vinde elektroner og blive negativt ladede ioner (anioner).
2. Elektrostatisk tiltrækning:
De modsatte anklager for kationen og anionen tiltrækker hinanden stærkt på grund af elektrostatiske kræfter. Denne attraktion er grundlaget for den ioniske binding.
3. Dannelse af en forbindelse:
Den elektrostatiske attraktion trækker ionerne sammen og danner en stabil, neutral forbindelse kaldet en ionisk forbindelse . Forbindelsen findes normalt som en krystalgitterstruktur.
4. Eksempler:
* natriumchlorid (NaCl): Natrium (NA) mister et elektron for at blive Na+, mens klor (CL) får et elektron til at blive Cl-. Den resulterende elektrostatiske tiltrækning danner den ioniske forbindelse natriumchlorid.
* magnesiumoxid (MGO): Magnesium (Mg) mister to elektroner for at blive Mg2+, mens ilt (O) får to elektroner til at blive O2-. Dette resulterer i det ioniske forbindelsesmagnesiumoxid.
5. Egenskaber ved ioniske forbindelser:
* høje smelte- og kogepunkter: På grund af stærke elektrostatiske kræfter.
* fast ved stuetemperatur: Ioniske forbindelser er typisk hårde og sprøde.
* Led elektricitet, når den er smeltet eller opløst: Ionerne er frit at bevæge sig og bære ladning.
Kortfattet: Blanding af en metalkation med en ikke -metal anion fører til dannelse af en stabil ionisk forbindelse, der er kendetegnet ved stærk elektrostatisk tiltrækning mellem modsat ladede ioner.
 Varme artikler
Varme artikler
-
 Kemikere programmerer flydende krystallinske elastomerer til at replikere komplekse vridningsvirknin…En simuleret LCE-mikropost med den nematiske direktør orienteret i 45 grader i forhold til den flade overflade. Belysning af den ene side af stolpen får toppen af stolpen til at vride sig i forhold
Kemikere programmerer flydende krystallinske elastomerer til at replikere komplekse vridningsvirknin…En simuleret LCE-mikropost med den nematiske direktør orienteret i 45 grader i forhold til den flade overflade. Belysning af den ene side af stolpen får toppen af stolpen til at vride sig i forhold -
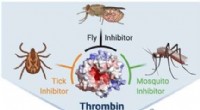 Potente trivalente hæmmere af thrombin fra antikoaguleringspeptider i insektspytKredit:Angewandte Chemie International Edition Trombose, tilstopning af blodkar, er en væsentlig årsag til hjerteanfald og emboli. Forskere har nu konstrueret de første hæmmere af thrombin, en pro
Potente trivalente hæmmere af thrombin fra antikoaguleringspeptider i insektspytKredit:Angewandte Chemie International Edition Trombose, tilstopning af blodkar, er en væsentlig årsag til hjerteanfald og emboli. Forskere har nu konstrueret de første hæmmere af thrombin, en pro -
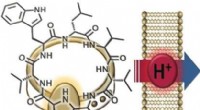 Kemisk syntese viser, at antibiotika fra den menneskelige næse virker ved protontranslokationKredit:Wiley Antibiotika-resistente bakterier er en stigende sundhedstrussel, gør nye antibiotika afgørende. Tyske forskere har for nylig haft et gennembrud:de opdagede lugdunin i den menneskelige
Kemisk syntese viser, at antibiotika fra den menneskelige næse virker ved protontranslokationKredit:Wiley Antibiotika-resistente bakterier er en stigende sundhedstrussel, gør nye antibiotika afgørende. Tyske forskere har for nylig haft et gennembrud:de opdagede lugdunin i den menneskelige -
 Forskere bruger mikrobølger til at måle tegn på dehydreringBillede, der viser mikrobølgesensorteknologisystem, der måler dråbe blod. Kredit:Queen Mary, University of London London og National Physical Laboratory (NPL) har med succes brugt mikrobølger til
Forskere bruger mikrobølger til at måle tegn på dehydreringBillede, der viser mikrobølgesensorteknologisystem, der måler dråbe blod. Kredit:Queen Mary, University of London London og National Physical Laboratory (NPL) har med succes brugt mikrobølger til
- Hvad er massen på 1 mol calciumatom?
- Forskere opdager nanokrystaller, der er i stand til at presse sig gennem nanorør uden at ændre sig
- Hvilken rolle spiller partikler i overførsel af varme?
- Hvorfor får du en knaldende lyd, når du tænder for gassen produceret af saltsyre og magnesium?
- Hvad er ionligningen for phosphorsyre og bariumhydroxid?
- Hvorfor bruger vi solenergi?


