Kan overgangsmetaller donere alle deres elektroner?
* Elektronkonfiguration: Overgangsmetaller har en unik elektronkonfiguration, hvor deres D-orbitaler udfyldes. De har typisk en delvist fyldt d-orbital skal. Mens de kan miste nogle elektroner fra deres ydre s-orbital og D-orbital, er det energisk ugunstigt at tømme d-orbitalen.
* stabilitet: Overgangsmetaller opnår generelt stabilitet ved at danne ioner med forskellige ladninger, afhængigt af det specifikke metal og situationen. De sigter mod at miste nok elektroner til enten:
* Opnå en ædel gaskonfiguration (som at miste to elektroner for at danne en +2 ion).
* Opret en halvfyldt eller fuldt fyldt D-Orbital, som er mere stabile konfigurationer.
* Eksempler:
* jern (Fe): Kan danne Fe 2+ (mister to elektroner) eller Fe 3+ (mister tre elektroner), men sjældent Fe 8+ (mister alle otte valenselektroner).
* kobber (CU): Kan danne cu + (mister en elektron) eller cu 2+ (mister to elektroner), men ikke Cu 11+ (mister alle elleve valenselektroner).
Undtagelser:
Selvom det er sjældne, er der nogle tilfælde, hvor overgangsmetaller formelt kan donere alle deres valenselektroner. Dette sker ofte i tilstande med høj oxidation og under ekstreme forhold, såsom:
* Høj oxidation angiver: F.eks. Mno 4 - (permanganation) har en MN 7+ Ion, formelt antyder, at alle syv valenselektroner er doneret.
* komplekse forbindelser: Nogle komplekse forbindelser, der involverer overgangsmetaller, kan udvise usædvanlige oxidationstilstande, hvilket potentielt kræver donation af alle valenselektroner.
Konklusion: Overgangsmetaller donerer typisk kun nogle af deres elektroner til dannelse af stabile ioner, der sigter mod konfigurationer, der maksimerer stabiliteten. De donerer sjældent alle deres valenselektroner.
 Varme artikler
Varme artikler
-
 Første gangs direkte bevis på kemiske reaktioner i partiklerMed denne enhed, partikler kan analyseres bedre end nogensinde før. Kredit:Paul Scherrer Institute/Mahir Dzambegovic Forskere ved Paul Scherrer Institute PSI har udviklet en ny metode til at analy
Første gangs direkte bevis på kemiske reaktioner i partiklerMed denne enhed, partikler kan analyseres bedre end nogensinde før. Kredit:Paul Scherrer Institute/Mahir Dzambegovic Forskere ved Paul Scherrer Institute PSI har udviklet en ny metode til at analy -
 Kemiske ingeniører fremmer produktionen af olefiner gennem beregningsmodelleringIllustration fra forsiden af ACS katalyse viser et vulkan aktivitetsplot, svarende til den, der er konstrueret i beregninger for at screene aktiviteten af forskellige steder på metaloxider, med to
Kemiske ingeniører fremmer produktionen af olefiner gennem beregningsmodelleringIllustration fra forsiden af ACS katalyse viser et vulkan aktivitetsplot, svarende til den, der er konstrueret i beregninger for at screene aktiviteten af forskellige steder på metaloxider, med to -
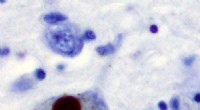 Ubrugeligt Parkinsons-molekyle spilder sine hemmelighederImmunhistokemi for alfa-synuclein, der viser positiv farvning (brun) af et intraneuralt Lewy-legeme i Substantia nigra ved Parkinsons sygdom. Kredit:Wikipedia Forskere fra UC San Francisco har for
Ubrugeligt Parkinsons-molekyle spilder sine hemmelighederImmunhistokemi for alfa-synuclein, der viser positiv farvning (brun) af et intraneuralt Lewy-legeme i Substantia nigra ved Parkinsons sygdom. Kredit:Wikipedia Forskere fra UC San Francisco har for -
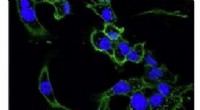 Polymer afledt af materiale i rejeskaller kunne levere anti-cancermedicin til tumorstederDisse billeder viser brystkræftceller fra mus taget under et mikroskop. På begge billeder grøn angiver cellemembranen, og blå angiver kernen. Celler i det nederste billede er blevet behandlet med Taxo
Polymer afledt af materiale i rejeskaller kunne levere anti-cancermedicin til tumorstederDisse billeder viser brystkræftceller fra mus taget under et mikroskop. På begge billeder grøn angiver cellemembranen, og blå angiver kernen. Celler i det nederste billede er blevet behandlet med Taxo
- Hvem er ansvarlig for vejaffald?
- Legioner af nanorobotter målretter mod kræftsvulster med præcision
- Nedtælling som SpaceX, NASA forbereder sig på at teste ny astronautkapsel
- Ud over kloning:Udnyt kraften ved virtuel kvanteudsendelse
- Er streaming af video fra skitserede websteder ulovligt?
- Beskyttelsesfrakke lavet af kork og cambium?


