Hvad er ædle gaskonfigurationer?
ædle gaskonfigurationer:En stabil tilstand af atomer
Ædle gaskonfigurationer henviser til elektronarrangement af atomer, der ligner den stabile konfiguration af ædelgasser. Disse gasser, der er placeret i gruppe 18 i den periodiske tabel (Helium, Neon, Argon, Krypton, Xenon og Radon), er utroligt ureaktive på grund af deres fulde ydre elektronskaller .
Her er en sammenbrud af konceptet:
1. Elektronskaller og underskaller:
- Atomer har elektroner, der kredser om deres kerne i forskellige energiniveauer kaldet skaller .
- Hver skal kan indeholde et vist maksimalt antal elektroner.
- skaller er yderligere opdelt i underskaller , betegnet som S, P, D og F, hvor hver har specifikke elektronkapaciteter.
2. Noble Gas Configuration:
- ædle gasser har en fuld ydre elektronskal, hvilket betyder, at alle deres underskaller er fyldt med det maksimale antal elektroner.
- Denne stabile konfiguration gør dem ekstremt ureaktive.
3. Opnåelse af ædelgaskonfiguration:
- Andre elementer stræber efter at opnå en ædelgaskonfiguration ved at vinde, miste eller dele elektroner gennem kemisk binding.
- Denne tendens driver kemiske reaktioner og danner grundlaget for kemiske bindingsteorier.
4. Brug af ædel gasnotation:
- Noble Gas Notation er en kortfattet måde at skrive elektronkonfigurationer på.
- Det bruger symbolet på den tidligere ædle gas efterfulgt af elektronkonfigurationen af de resterende elektroner.
- For eksempel har natrium (NA) 11 elektroner. Dens elektronkonfiguration er 1S² 2S²2P⁶3S¹. Ved hjælp af ædel gasnotation skriver vi den som [NE] 3S¹. Dette betyder, at natrium har den samme elektronkonfiguration som neon (1S² 2S²2P⁶) plus en yderligere elektron i 3S -underskallen.
5. Betydningen af ædelgaskonfiguration:
- Forståelse af ædelgaskonfigurationer hjælper med at forudsige elementernes reaktivitet og kemiske opførsel.
- Det giver en ramme for at forklare kemisk binding og dannelse af forbindelser.
- Det er et grundlæggende koncept inden for kemi, der hjælper med at forstå stofs struktur og egenskaber.
Afslutningsvis repræsenterer ædle gaskonfigurationer den stabile tilstand af atomer, hvor deres ydre skaller er fuldstændigt fyldt med elektroner. At forstå dette koncept er afgørende for at gribe ind i principperne om kemisk binding og opførslen af elementer i kemiske reaktioner.
 Varme artikler
Varme artikler
-
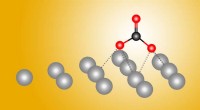 En sølvkugle til kemisk omdannelse af kuldioxidForskere opdager et overraskende første trin i den kemiske transformation af kuldioxid ved hjælp af en sølvkatalysator. Kredit:Berkeley Lab Fossile brændstoffer er livsnerven i moderne samfund, me
En sølvkugle til kemisk omdannelse af kuldioxidForskere opdager et overraskende første trin i den kemiske transformation af kuldioxid ved hjælp af en sølvkatalysator. Kredit:Berkeley Lab Fossile brændstoffer er livsnerven i moderne samfund, me -
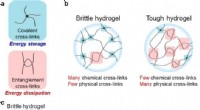 En universel metode til nemt at designe seje og strækbare hydrogelerSkema af hydrogeler med fysiske og kemiske tværbindinger. (a) Kovalente og sammenfiltrede tværbindinger til energilagring og -dissipation, henholdsvis. (b) Kemisk og fysisk tværbundne strukturer af sk
En universel metode til nemt at designe seje og strækbare hydrogelerSkema af hydrogeler med fysiske og kemiske tværbindinger. (a) Kovalente og sammenfiltrede tværbindinger til energilagring og -dissipation, henholdsvis. (b) Kemisk og fysisk tværbundne strukturer af sk -
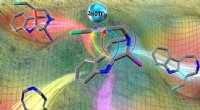 Næste generations medicin:Hvor kemi møder beregningEn kunstners skildring af den programmerbare divergerende synteseproces. Kredit:Hiroki Oguri, TUAT En gruppe japanske forskere hovedsageligt fra Tokyo University of Agriculture and Technology (TUA
Næste generations medicin:Hvor kemi møder beregningEn kunstners skildring af den programmerbare divergerende synteseproces. Kredit:Hiroki Oguri, TUAT En gruppe japanske forskere hovedsageligt fra Tokyo University of Agriculture and Technology (TUA -
 Nye materialer kunne drive sårheling ved at udnytte naturlige helingsmetoderKredit:CC0 Public Domain Materialer er meget brugt til at hjælpe med at hele sår:Kollagensvampe hjælper med at behandle forbrændinger og tryksår, og stilladslignende implantater bruges til at repa
Nye materialer kunne drive sårheling ved at udnytte naturlige helingsmetoderKredit:CC0 Public Domain Materialer er meget brugt til at hjælpe med at hele sår:Kollagensvampe hjælper med at behandle forbrændinger og tryksår, og stilladslignende implantater bruges til at repa
- Billede:James Webb Space Telescope lyser ud inspektion
- FN's sundhedsagentur sætter højere, hårdere bar for luftkvaliteten
- Hvad er metoderne til at detektere og måle ekstrasolære planeter?
- Hvorfor det kunne gavne bjørne og fiskere at lade laksen slippe ud
- Nordsøvand og genbrugsmetal kombineret for at hjælpe med at reducere den globale opvarmning
- Den britiske telekomkoncern BT siger, at administrerende direktør vil træde tilbage


