Hvorfor er citronsyre en svag syre?
* Stærke syrer: Disse syrer adskiller sig fuldstændigt (bryder fra hinanden) i deres ioner, når de blev opløst i vand. For eksempel bryder saltsyre (HCI) ind i H+ og Cl- ioner, hvilket frigiver alle dens hydrogenioner (H+).
* svage syrer: Disse syrer adskiller sig kun delvist i vand, hvilket betyder, at de kun frigiver en lille del af deres hydrogenioner (H+). Citronsyre, mens den er sur, donerer ikke alle dens brintioner, når de opløses i vand.
Hvorfor er citronsyre svag?
Strukturen af citronsyre spiller en rolle:
* flere carboxylgrupper: Citronsyre har tre carboxylgrupper (-COOH), hver med et brint, der kan doneres. Imidlertid er disse grupper forbundet til det samme molekyle, og tilstedeværelsen af en carboxylgruppe påvirker de andres evne til at donere brintioner.
* Stabilitet af den konjugatbase: Når citronsyre mister en hydrogenion, danner den en negativt ladet konjugatbase. Denne konjugatbase er relativt stabil, hvilket gør det mindre sandsynligt, at syren mister en anden hydrogenion.
Kortfattet:
Citronsyre er en svag syre, fordi den kun delvis ioniserer i vand. Dette skyldes dens struktur og stabiliteten af dens konjugatbase. Det frigiver ikke alle sine brintioner, som en stærk syre ville, og derfor ville klassificeringen som "svag."
Sidste artikelHvilke typer binding er vand?
Næste artikelHvad er den kemiske gruppe af sort onyx?
 Varme artikler
Varme artikler
-
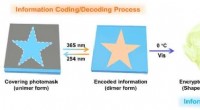 Ny fluorescerende organohydrogel foreslået for at opnå dobbelt informationskrypteringInformationskodning/dekodning og kryptering/dekryptering baseret på den fluorescerende organohydrogel. Kredit:NIMTE Smart Polymer Materials Group ledet af prof. Chen Tao ved Ningbo Institute of Mat
Ny fluorescerende organohydrogel foreslået for at opnå dobbelt informationskrypteringInformationskodning/dekodning og kryptering/dekryptering baseret på den fluorescerende organohydrogel. Kredit:NIMTE Smart Polymer Materials Group ledet af prof. Chen Tao ved Ningbo Institute of Mat -
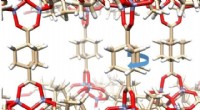 Gyroskopmolekyler danner krystal, der er både fast og fuld af bevægelseUCLA -forskere dannede en krystal ud af molekyler, der hver har et solidt ydre, men indeholder bevægelige dele. Kredit:Kendall Houk Laboratory/UCLA Molekylære maskiner, meget mindre end enkeltcell
Gyroskopmolekyler danner krystal, der er både fast og fuld af bevægelseUCLA -forskere dannede en krystal ud af molekyler, der hver har et solidt ydre, men indeholder bevægelige dele. Kredit:Kendall Houk Laboratory/UCLA Molekylære maskiner, meget mindre end enkeltcell -
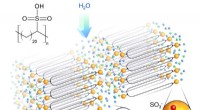 Ingeniører designer ny fast polymer elektrolyt, baner vejen for sikrere, mindre batterier og brænd…Forskernes nye struktur samles selv til hårnåleformer, resulterer i syreforede kanaler, der muliggør effektiv transport af protoner hen over elektrolytten. Kredit:Nature Materials Brændselsceller
Ingeniører designer ny fast polymer elektrolyt, baner vejen for sikrere, mindre batterier og brænd…Forskernes nye struktur samles selv til hårnåleformer, resulterer i syreforede kanaler, der muliggør effektiv transport af protoner hen over elektrolytten. Kredit:Nature Materials Brændselsceller -
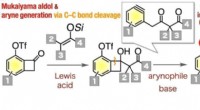 En dejlig reaktiv ring til det:Nye syntetiske veje til forskellige aromatiske forbindelserMukaiyama aldol-reaktionen af 6-(triflyloxy)benzocyclobutenoner med ketensilylacetaler og efterfølgende generering af aryner af γ-aryl-β-ketoester-type fra resulterende 6-(triflyloxy)benzocyclobuten
En dejlig reaktiv ring til det:Nye syntetiske veje til forskellige aromatiske forbindelserMukaiyama aldol-reaktionen af 6-(triflyloxy)benzocyclobutenoner med ketensilylacetaler og efterfølgende generering af aryner af γ-aryl-β-ketoester-type fra resulterende 6-(triflyloxy)benzocyclobuten
- Geologer finder ud af, hvordan over 2,6 Ga år gamle sten blev dannet på Limpopo Complex
- Hvor stor en procentdel af solenergien når den ydre atmosfære absorberes på jordens overflade?
- Milliardæren Richard Branson når plads i sit eget skib
- Hvad er de 3 aspekter af videnskab?
- NASA finder et udbrud af energi i at svække depressionen Dalila
- Når hudfarve ar:Skaden ved kolorisme blandt asiatisk-amerikanere


