Hvorfor er naturgas og dampreformeringsreaktion endotermisk?
reaktionen:
Den primære reaktion i dampreformering er omdannelsen af methan (CH4) med damp (H2O) til at producere syntesegas (Syngas), en blanding af kulilte (CO) og brint (H2):
CH4 + H2O ⇌ CO + 3H2
Hvorfor er det endotermisk:
1.
-Metanmolekylet har stærke C-H-bindinger, og vand har en stærk H-O-binding. Energi kræves for at bryde disse obligationer.
2. danner svagere obligationer:
- Produkterne, kulilte og brint har svagere bindinger sammenlignet med reaktanterne. C =O-bindingen i CO og H-H-bindingen i H2 er svagere end C-H- og H-O-bindingerne i henholdsvis metan og vand.
3. Energibalance:
- Den energi, der kræves for at bryde bindingerne i reaktanterne, er større end den frigivne energi, når de svagere bindinger i produktformen. Denne forskel i energi absorberes fra omgivelserne, hvilket gør reaktionen endotermisk.
Praktiske implikationer:
- krav til høj temperatur: Dampreformering kræver en høj temperatur (typisk 700-900 ° C) for at tilvejebringe den nødvendige energi til, at reaktionen fortsætter.
- Energiindgang: Den endotermiske karakter af reaktionen betyder, at eksterne varmekilder er påkrævet for at opretholde processen.
- termodynamiske overvejelser: Reaktionens ligevægt favoriserer produktdannelse ved højere temperaturer, hvilket gør den endotermiske natur til gavn for at opnå højere konverteringer.
Kortfattet:
Naturgas- og dampreformeringsreaktionen er endotermisk, fordi den involverer nettoforbruget af energi til at bryde stærkere bindinger i reaktanterne og danne svagere bindinger i produkterne. Denne energiindgang er afgørende for at drive reaktionen og producere syntesegas.
 Varme artikler
Varme artikler
-
 Sammensmeltet billedbehandling afslører skrift fra det sjette århundrede skjult inde i bogbindingEfter at have været skjult i århundreder, hemmelighederne i middelalderlige manuskripter kan snart komme frem i lyset. Ved at fusionere to billeddannelsesteknikker - synlig hyperspektral billeddannel
Sammensmeltet billedbehandling afslører skrift fra det sjette århundrede skjult inde i bogbindingEfter at have været skjult i århundreder, hemmelighederne i middelalderlige manuskripter kan snart komme frem i lyset. Ved at fusionere to billeddannelsesteknikker - synlig hyperspektral billeddannel -
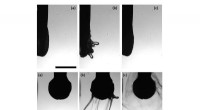 Polymerer forhindrer potentielt farlig tåge under tandlægebesøgBrug af polyakrylsyreopløsning i vand som vandingsvæske i tandplejen reducerer risikoen for aerosolformede patogener. Her, polymeren er vist og danner slangelignende tråde nær spidsen af en vibreren
Polymerer forhindrer potentielt farlig tåge under tandlægebesøgBrug af polyakrylsyreopløsning i vand som vandingsvæske i tandplejen reducerer risikoen for aerosolformede patogener. Her, polymeren er vist og danner slangelignende tråde nær spidsen af en vibreren -
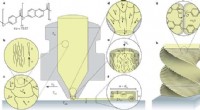 3D-udskrivning hierarkiske flydende krystal-polymerstrukturerUdskrivning af hierarkiske termotrope LCPer ved hjælp af fusioneret deponeringsmodellering. a) korte stavlignende polymerkæder dannet af en aromatisk tilfældig copolymer bestående af de stive monomere
3D-udskrivning hierarkiske flydende krystal-polymerstrukturerUdskrivning af hierarkiske termotrope LCPer ved hjælp af fusioneret deponeringsmodellering. a) korte stavlignende polymerkæder dannet af en aromatisk tilfældig copolymer bestående af de stive monomere -
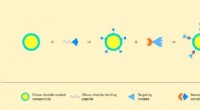 Forskere udvikler molekylær samlingsmetode til kræftterapi og diagnostikIllustration af samlingen af strukturen baseret på en nanopartikel og protein-komplekset barnase-barstar. Kredit:Forfattere af papiret og Lion_on_helium, MIPT Biofysikere har udviklet en metode
Forskere udvikler molekylær samlingsmetode til kræftterapi og diagnostikIllustration af samlingen af strukturen baseret på en nanopartikel og protein-komplekset barnase-barstar. Kredit:Forfattere af papiret og Lion_on_helium, MIPT Biofysikere har udviklet en metode
- Hvad gør syre til a og base base?
- Chatbot eller menneske? Uanset hvad, der betyder noget for kundernes tillid, er opfattet menneskelig…
- Forholdet mellem geotermisk energi og lithium
- Godt begyndt er halvt færdig? Forskere studerer opskriften på effektiv proteinsyntese
- Hvilken planet tiltrækker andre genstande gennem tyngdekraften?
- Hvad er den generelle struktur af plasmamembranen?


