Et stof er sammensat af 6 g silicium og 2,5 klor, hvis den korrekte molekylmasse 378 så hvilken formel?
1. Bestem molen for hvert element:
* silicium (SI):
- Molmasse Si =28,09 g/mol
- mol Si =(6 g) / (28,09 g / mol) =0,214 mol
* klor (Cl):
- Molmasse Cl =35,45 g/mol
- mol Cl =(2,5 g) / (35,45 g / mol) =0,0706 mol
2. Find molforholdet:
* Opdel antallet af mol af hvert element med det mindste antal mol:
- SI:0,214 mol / 0,0706 mol ≈ 3
- Cl:0,0706 mol / 0,0706 mol ≈ 1
3. Bestem den empiriske formel:
* Molforholdet giver os den empiriske formel: si₃cl
4. Beregn den empiriske formelmasse:
* (3 x 28,09 g/mol) + (1 x 35,45 g/mol) =123,72 g/mol
5. Bestem den molekylære formel:
* Opdel den givne molekylmasse med den empiriske formelmasse:
- 378 g/mol/123,72 g/mol ≈ 3
* Multiplicer underskrifterne i den empiriske formel med denne faktor:
- si₃cl x 3 = si₉cl₃
Derfor er stoffets molekylære formel si₉cl₃.
 Varme artikler
Varme artikler
-
 Oprettelse af en hurtigere, on-site måde at påvise visse alkylstofferKredit:CC0 Public Domain Curtin University forskning har udviklet en ny og lettere on-site metode til straks og præcist at opdage og måle niveauer af PFAS, som er vedvarende miljøforurenende stoff
Oprettelse af en hurtigere, on-site måde at påvise visse alkylstofferKredit:CC0 Public Domain Curtin University forskning har udviklet en ny og lettere on-site metode til straks og præcist at opdage og måle niveauer af PFAS, som er vedvarende miljøforurenende stoff -
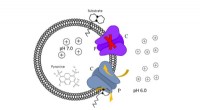 Arbejder på at opdage nye behandlinger mod tuberkuloseMmpL3 er det vigtigste mål for opdagelsen af nye anti-tuberkuloselægemidler. Zgurskaya og medforfattere isolerede dette mål fra bakterieceller og rekonstituerede det i kunstige membraner. Dette skab
Arbejder på at opdage nye behandlinger mod tuberkuloseMmpL3 er det vigtigste mål for opdagelsen af nye anti-tuberkuloselægemidler. Zgurskaya og medforfattere isolerede dette mål fra bakterieceller og rekonstituerede det i kunstige membraner. Dette skab -
 Agroindustrielt affald kan bruges som materiale til boliger og infrastrukturEt projekt med fokus på brugen af ikke-giftige materialer og bæredygtig produktion har allerede skabt fibercementpaneler og biomassespånplader til flere formål (foto:Eduardo César / Pesquisa FAPESP
Agroindustrielt affald kan bruges som materiale til boliger og infrastrukturEt projekt med fokus på brugen af ikke-giftige materialer og bæredygtig produktion har allerede skabt fibercementpaneler og biomassespånplader til flere formål (foto:Eduardo César / Pesquisa FAPESP -
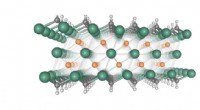 Tager 2D-materialer til MAXMXener er dækket med metal-oxygen og metal-hydroxyl (f.eks. Ti-OH) bindinger, som er kemisk og elektrokemisk aktive. Kredit:KAUST Opdaget af forskere ved Drexel University som elektroder til energ
Tager 2D-materialer til MAXMXener er dækket med metal-oxygen og metal-hydroxyl (f.eks. Ti-OH) bindinger, som er kemisk og elektrokemisk aktive. Kredit:KAUST Opdaget af forskere ved Drexel University som elektroder til energ
- Hvilke problemer har astronomer, når man kigger gennem teleskoper?
- Forskere offentliggør en detaljeret gennemgang af elektriske kontakter i ét og todimensionalt nano…
- Hvorfor har elementet med lavest atomnummer største radier i hver periode?
- Forskere teleporterer information inden for en diamant
- Hvor bevæger brintpumper ioner i hvilken struktur?
- Hvad er fusion af to gameter til dannelse af en diploid zygote?


