Hvilke polære og ikke -molokuler er?
polære molekyler
* Definition: Polære molekyler har en ujævn fordeling af elektrondensitet, hvilket resulterer i en adskillelse af ladning (positive og negative poler).
* Årsag: Denne ujævne fordeling stammer fra forskelle i elektronegativitet mellem atomerne i molekylet. Elektronegativitet er et atomens tendens til at tiltrække elektroner mod sig selv i en kemisk binding.
* Nøgleegenskaber:
* dipolmoment: Polære molekyler har et netto dipolmoment, et mål for adskillelsen af ladning.
* opløselighed: De har en tendens til at være opløselige i polære opløsningsmidler som vand.
* Intermolekylære kræfter: Stærke intermolekylære kræfter som hydrogenbinding, som bidrager til højere kogepunkter.
* Eksempler:
* vand (H₂O): Oxygen er mere elektronegativt end brint, hvilket gør iltenden af molekylet lidt negativt, og brintet ender lidt positivt.
* hydrogenchlorid (HCL): Klor er mere elektronegativ end brint, hvilket gør klorenden af molekylet lidt negativt.
* ammoniak (NH₃): Nitrogen er mere elektronegativ end brint.
ikke -polære molekyler
* Definition: Ikke -polære molekyler har en jævn fordeling af elektrondensitet, hvilket betyder, at der ikke er nogen signifikant adskillelse af ladning.
* Årsag: Atomer med lignende elektronegativiteter deler elektroner lige i bindingerne.
* Nøgleegenskaber:
* Intet dipolmoment: Ikke -polære molekyler har intet netto dipolmoment.
* opløselighed: De har en tendens til at være opløselige i ikke -polære opløsningsmidler som olie eller fedt.
* Intermolekylære kræfter: Svage intermolekylære kræfter som London Dispersion Forces, hvilket resulterer i lavere kogepunkter.
* Eksempler:
* methan (ch₄): Elektronegativitetsforskellen mellem kulstof og brint er meget lille.
* kuldioxid (co₂): Molekylet er lineært, og dipolerne af carbon-iltbindingerne annullerer hinanden.
* ilt (O₂): Begge iltatomer har den samme elektronegativitet.
Kortfattet
Begrebet polaritet er afgørende for at forstå, hvordan molekyler interagerer med hinanden og med deres miljø. Det påvirker egenskaber som opløselighed, kogepunkt og biologisk aktivitet.
 Varme artikler
Varme artikler
-
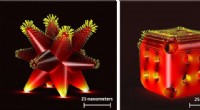 Metalkatalysatorer, der bruges til miljømæssig bæredygtighed, viste sig at nedbrydes og blive min…Nogle af de komplekse strukturelle arrangementer af katalysatorer; venstre er kendt som forgrenet struktur og højre som burstruktur. Kredit:Professor Anna Klinkova fra University of Waterloo Ny fo
Metalkatalysatorer, der bruges til miljømæssig bæredygtighed, viste sig at nedbrydes og blive min…Nogle af de komplekse strukturelle arrangementer af katalysatorer; venstre er kendt som forgrenet struktur og højre som burstruktur. Kredit:Professor Anna Klinkova fra University of Waterloo Ny fo -
 Takket være maskinlæring, fremtiden for katalysatorforskning er nu300 kvaternære katalysatorer udtages tilfældigt fra et stort materialerum, hvor deres ydeevne i forhold til OCM systematisk evalueres ved eksperimenter med høj gennemstrømning, efterfulgt af maskinlær
Takket være maskinlæring, fremtiden for katalysatorforskning er nu300 kvaternære katalysatorer udtages tilfældigt fra et stort materialerum, hvor deres ydeevne i forhold til OCM systematisk evalueres ved eksperimenter med høj gennemstrømning, efterfulgt af maskinlær -
 Ultrahurtige elektroner i magnetiske oxider:En ny retning for spintronics?Kredit:CC0 Public Domain Særlige metaloxider kan en dag erstatte halvledermaterialer, der almindeligvis bruges i dag i processorer. Nu, for første gang, et internationalt forskerteam fra Martin Lu
Ultrahurtige elektroner i magnetiske oxider:En ny retning for spintronics?Kredit:CC0 Public Domain Særlige metaloxider kan en dag erstatte halvledermaterialer, der almindeligvis bruges i dag i processorer. Nu, for første gang, et internationalt forskerteam fra Martin Lu -
 Overstrømning:Hemmelighederne ved denne stinkende svenske fiskKredit:The American Chemical Society Det er blevet kaldt den lugtende mad i verden. Men surströmming - svensk for sur sild - er elsket i Sverige som en sommerglæde. I denne video, Reactions for
Overstrømning:Hemmelighederne ved denne stinkende svenske fiskKredit:The American Chemical Society Det er blevet kaldt den lugtende mad i verden. Men surströmming - svensk for sur sild - er elsket i Sverige som en sommerglæde. I denne video, Reactions for
- Musikens fysik: Bølger, beats og frekvenser
- Økonomer udforsker råvarers værdifulde roller for internationale aktiemarkeder
- Hvor mange gange surere er en opløsning med pH 1 end at have 2?
- Hvor mange alleler har en ærteplante-gamete for højdegenet?
- Hvordan reagerede Florida ikke på en koralsygdomsepidemi, og hvad følger?
- Nyligt beskrevet solur kan præcist forudsige solcyklusbegivenheder år i forvejen


