Sammenlignet med hastigheden for en uorganisk reaktion er organisk normalt?
Her er hvorfor:
* obligationsstyrke: Organiske molekyler er primært afhængige af carbon-carbon- og carbon-hydrogenbindinger, som er relativt stærke. At bryde disse obligationer kræver mere energi og bremser reaktionen. Uorganiske forbindelser har ofte svagere bindinger, hvilket fører til hurtigere reaktioner.
* reaktionsmekanismer: Organiske reaktioner involverer ofte komplekse flertrinsmekanismer med mellemtrin, der kræver specifikke betingelser (temperatur, katalysatorer) for at fortsætte. Denne kompleksitet tilføjer tid til den samlede reaktion.
* sterisk hindring: Organiske molekyler kan have komplekse strukturer med voluminøse grupper. Denne "steriske hindring" kan hindre reaktanters tilgang, hvilket gør det vanskeligt for dem at kollidere og reagere.
Eksempler:
* forbrænding: Brændende træ (et organisk materiale) er langsommere end brændende metan (en uorganisk forbindelse).
* neutralisering: Neutralisering af en stærk syre (som saltsyre) med en stærk base (som natriumhydroxid) er meget hurtigere end hydrolysen af en ester (en organisk reaktion).
Undtagelser:
Mens de generelt er langsommere, kan nogle organiske reaktioner være meget hurtige:
* SN1- og SN2 -reaktioner: Disse reaktioner, der involverer nukleofiler, kan være meget hurtige afhængigt af underlaget og nukleofilen.
* forbrænding af kulbrinter: Visse stærkt reaktive kulbrinter kan brænde meget hurtigt, såsom metan.
Generelt afhænger en reaktionshastighed af mange faktorer, herunder de specifikke reaktanter, reaktionsbetingelser og tilstedeværelsen af katalysatorer. Mens uorganiske reaktioner ofte er hurtigere, er der også adskillige eksempler på hurtige organiske reaktioner.
Sidste artikelHvad er eksempel på tri atomelementer?
Næste artikelHvilke polære og ikke -molokuler er?
 Varme artikler
Varme artikler
-
 Nyt aluminium og samarium hexaborid-baseret kompositmateriale med næsten nul ekspansionTypiske optiske mikrografer af kompositmaterialet Kredit:Serebrennikov et al. / Resultater i fysik, 2021 Præcisions- eller invarlegeringer er blevet udviklet af forskere i mange århundreder. Disse
Nyt aluminium og samarium hexaborid-baseret kompositmateriale med næsten nul ekspansionTypiske optiske mikrografer af kompositmaterialet Kredit:Serebrennikov et al. / Resultater i fysik, 2021 Præcisions- eller invarlegeringer er blevet udviklet af forskere i mange århundreder. Disse -
 Video:Hvorfor antarktiske fisk ikke fryser ihjelKredit:The American Chemical Society De notothenioidfisk, der bor i det Antarktiske Ocean, har udviklet en usædvanlig tilpasning til at leve i iskolde farvande. Deres blod indeholder frostvæskepr
Video:Hvorfor antarktiske fisk ikke fryser ihjelKredit:The American Chemical Society De notothenioidfisk, der bor i det Antarktiske Ocean, har udviklet en usædvanlig tilpasning til at leve i iskolde farvande. Deres blod indeholder frostvæskepr -
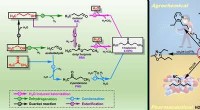 Forskere fremmer biomassetransformationsprocessen(A) Dette er en foreslået reaktionsvej, der fører til 4-HPO. (B) Dette er 4-HPO-udnyttelse. Kredit:DICP Biomasse kan tjene som en vedvarende kilde til både energi og kulstof. Acetone, n-butanol, o
Forskere fremmer biomassetransformationsprocessen(A) Dette er en foreslået reaktionsvej, der fører til 4-HPO. (B) Dette er 4-HPO-udnyttelse. Kredit:DICP Biomasse kan tjene som en vedvarende kilde til både energi og kulstof. Acetone, n-butanol, o -
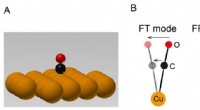 Belysning af vibrationsenergi af et enkelt molekyle i et eksternt kraftfeltFigur 1A:Skematisk billede af et enkelt CO-molekyle i ensomhed adsorberet på en enkelt kobberkrystal. 1B:Skematiske billeder af vibrationer af et CO-molekyle adsorberet på en kobberoverflade. Et CO-mo
Belysning af vibrationsenergi af et enkelt molekyle i et eksternt kraftfeltFigur 1A:Skematisk billede af et enkelt CO-molekyle i ensomhed adsorberet på en enkelt kobberkrystal. 1B:Skematiske billeder af vibrationer af et CO-molekyle adsorberet på en kobberoverflade. Et CO-mo
- Dechifrering af, hvordan krystaller dannes på ikke-klassiske måder
- Afrikas faste affald vokser, udgør en klimatrussel
- Hvad er massetallet for et atom med 11 protoner elektroner 12 neutroner?
- Top 10 grunde til at reducere, genbruge og genbruge
- Hvad var formålet med Mercury -programmet?
- Følelsesmæssigt stabile mennesker bruger mere i ferien, ifølge ny undersøgelse


