Hvordan kan katalysatoren gøre det muligt for en reaktion at ske hurtigere?
1. Aktiveringsenergi:
* Hver kemisk reaktion har brug for en vis mængde energi til at starte, kaldet aktiveringsenergien. Dette er som at skubbe en klippe op ad bakke - du er nødt til at gøre en indsats for at få den i bevægelse.
* Jo højere aktiveringsenergi, desto sværere er det at starte reaktionen, og jo langsommere fortsætter den.
2. Katalysatorer Lavere aktiveringsenergien:
* Katalysatorer fungerer ved at skabe en ny vej til reaktionen med en lavere aktiveringsenergi. Det er som at finde en glattere sti for at få klippen til at bevæge sig.
* Dette gør det muligt for flere molekyler at have nok energi til at reagere, hvilket fører til en hurtigere reaktionshastighed.
3. Hvordan katalysatorer fungerer (generelt):
* interaktion: Katalysatorer interagerer med reaktanterne, danner midlertidige bindinger eller mellemprodukter. Dette bringer reaktanterne tættere sammen og i den rigtige orientering til reaktion.
* stabilisering: Katalysatorer stabiliserer overgangstilstanden, som er den ustabile mellemtilstand mellem reaktanter og produkter. Dette sænker energibarrieren for reaktionen.
* regenerering: Efter lettelse af reaktionen regenereres katalysatorer i deres oprindelige form og kan katalysere yderligere reaktioner.
Eksempel:
Forestil dig, at du prøver at brænde en log. Det kræver en masse energi at komme i gang (høj aktiveringsenergi). En katalysator som en kamp giver en lavere energi -vej (flammen) til at antænde træet. Når træet brænder, er kampen ikke længere nødvendig.
Nøglepunkter:
* Katalysatorer ændrer ikke den samlede ligevægt af en reaktion; De fremskynder det kun.
* De forbruges ikke i reaktionen.
* Forskellige katalysatorer er specifikke for forskellige reaktioner.
Ved at sænke aktiveringsenergien gør katalysatorer gør det muligt for reaktioner at fortsætte hurtigere og øge hastigheden for produktdannelse. Dette er afgørende i mange industrielle processer, biologiske systemer og hverdagen.
 Varme artikler
Varme artikler
-
 Optimering af brugen af rengøringsteknologierPlacering af fuld kegle dyser i et CAD miljø. Kredit:Fraunhofer-Gesellschaft Vi kender det fra vores eget hjem:omfangsrige køkkenredskaber og hvidevarer er svære at rengøre. I industrien, kompleks
Optimering af brugen af rengøringsteknologierPlacering af fuld kegle dyser i et CAD miljø. Kredit:Fraunhofer-Gesellschaft Vi kender det fra vores eget hjem:omfangsrige køkkenredskaber og hvidevarer er svære at rengøre. I industrien, kompleks -
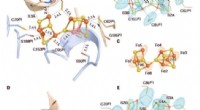 Strukturelt bevis for en dynamisk metallocofaktor under dinitrogenreduktion ved Mo-nitrogenaseDe oxiderede P-klynger i Av1*. Strukturer af P-klynger ved (A til C) grænsefladen mellem kæder A og B [P-klynge (A/B)] og (D til F) grænsefladen mellem kæder C og D [P-klynge (C/D) ] af Av1*. Kæder A
Strukturelt bevis for en dynamisk metallocofaktor under dinitrogenreduktion ved Mo-nitrogenaseDe oxiderede P-klynger i Av1*. Strukturer af P-klynger ved (A til C) grænsefladen mellem kæder A og B [P-klynge (A/B)] og (D til F) grænsefladen mellem kæder C og D [P-klynge (C/D) ] af Av1*. Kæder A -
 Ny katalysator gør styrenfremstilling billigere, grønnereKredit:North Carolina State University Kemiingeniørforskere har udviklet en ny katalysator, der markant øger udbyttet i styrenfremstilling, samtidig med at energiforbruget og drivhusgasemissionern
Ny katalysator gør styrenfremstilling billigere, grønnereKredit:North Carolina State University Kemiingeniørforskere har udviklet en ny katalysator, der markant øger udbyttet i styrenfremstilling, samtidig med at energiforbruget og drivhusgasemissionern -
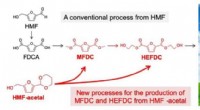 Grøn plastproduktion gjort letFigur 1. Reaktionsvej for produktion af MFDC og HEFDC fra HMF (en konventionel proces) og HMF-acetal (nye one-pot processer). Kredit:Kiyotaka Nakajima, Hokkaido Universitet En et-trins metode muli
Grøn plastproduktion gjort letFigur 1. Reaktionsvej for produktion af MFDC og HEFDC fra HMF (en konventionel proces) og HMF-acetal (nye one-pot processer). Kredit:Kiyotaka Nakajima, Hokkaido Universitet En et-trins metode muli
- Hvordan fungerer alle dele af en plantecelle?
- Grafenskum bliver stort og sejt:Nanorør-forstærket materiale kan formes, er meget ledende
- Gammel migration var valg, ikke tilfældighed, undersøgelse finder
- Her er, hvordan hackere gør din Tesla, GM og Chrysler mindre sårbare over for angreb
- Frekvensstabile lasersystemer til rummet
- Facebooks administrerende direktør Mark Zuckerberg har en besked til dig:Han er ligeglad med, om du…


