Hvordan er den kemiske formel for en syre forskellig fra en base?
syrer:
* Generel formel: Start normalt med h (brint), efterfulgt af en ikke-metal eller en polyatomisk ion.
* i løsning: De frigiver hydrogenioner (H+) Når det er opløst i vand, gør opløsningen mere sur.
* Eksempler: HCI (saltsyre), HNO3 (salpetersyre), H2SO4 (svovlsyre), CH3COOH (eddikesyre)
baser:
* Generel formel: Indeholder normalt et metal eller ammoniak (NH3) .
* i løsning: De frigiver hydroxidioner (OH-) Når det er opløst i vand, gør opløsningen mere alkalisk (grundlæggende).
* Eksempler: NaOH (natriumhydroxid), KOH (kaliumhydroxid), Ca (OH) 2 (calciumhydroxid), NH3 (ammoniak)
Vigtige noter:
* Ikke alle forbindelser, der starter med H, er syrer: For eksempel er H2O (vand) neutral.
* Ikke alle forbindelser, der indeholder OH, er baser: For eksempel er CH3OH (methanol) ikke en base.
* Der er også Brønsted-Lowry og Lewis syre-base-teorier: Disse teorier fokuserer på evnen til at donere eller acceptere protoner eller elektronpar, som kan udvide definitionen ud over kun H+ og OH-.
Sammenfattende, mens den generelle formel kan være en nyttig indikator, er definerende karakteristik for syrer frigivelsen af H+ -ioner, mens baser frigiver ohonioner Når det er opløst i vand.
 Varme artikler
Varme artikler
-
 MIT opstart pakker mad ind i silke for bedre holdbarhedEn spiselig silkebaseret belægning udviklet af MIT-adjunkt Benedetto Marelli kan bevare mad længere og forhindre madspild. Marelli har indgået et samarbejde med andre Boston-baserede forskere for at d
MIT opstart pakker mad ind i silke for bedre holdbarhedEn spiselig silkebaseret belægning udviklet af MIT-adjunkt Benedetto Marelli kan bevare mad længere og forhindre madspild. Marelli har indgået et samarbejde med andre Boston-baserede forskere for at d -
 Tilføjelse af en polymer stabiliserer sammenfaldende metal-organiske rammerPolymer seler, placeret i MOFer med store porer, være med til at hæmme sammenbrud af rammerne. Kredit:Li Peng (EPFL) Metalorganiske rammer (MOFer) er en særlig klasse af svampelignende materialer
Tilføjelse af en polymer stabiliserer sammenfaldende metal-organiske rammerPolymer seler, placeret i MOFer med store porer, være med til at hæmme sammenbrud af rammerne. Kredit:Li Peng (EPFL) Metalorganiske rammer (MOFer) er en særlig klasse af svampelignende materialer -
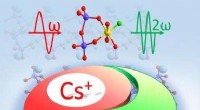 Forskning afdækker det første ikke-centrosymmetriske fluorooxosilicophosphat med Si-F-bindingerSkematisk illustration af forskningen. Kredit:Prof. LUOs gruppe Dyb-ultraviolette (UV) ikke-lineære optiske materialer spiller en afgørende rolle i en række forskellige højteknologiske videnskabel
Forskning afdækker det første ikke-centrosymmetriske fluorooxosilicophosphat med Si-F-bindingerSkematisk illustration af forskningen. Kredit:Prof. LUOs gruppe Dyb-ultraviolette (UV) ikke-lineære optiske materialer spiller en afgørende rolle i en række forskellige højteknologiske videnskabel -
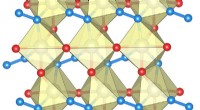 Ekstremt hårdt, men metallisk ledende:Forskere udvikler nyt materiale med højteknologiske udsigterStrukturen af rheniumnitridpernitrid indeholdende enkelte nitrogenatomer (rød) og N-N nitrogenhåndvægte (blå). Større kugler viser rheniumatomer. Kredit:Maxim Byko En international forskergruppe
Ekstremt hårdt, men metallisk ledende:Forskere udvikler nyt materiale med højteknologiske udsigterStrukturen af rheniumnitridpernitrid indeholdende enkelte nitrogenatomer (rød) og N-N nitrogenhåndvægte (blå). Større kugler viser rheniumatomer. Kredit:Maxim Byko En international forskergruppe
- Ny undersøgelse af jordskorpen viser global vækstspurt for tre milliarder år siden
- Potentiel toksicitet af cellulosenanokrystaller undersøgt
- Hvorfor værktøjssvingende krager er venstre- eller højrenæbbede
- Hvad er adjektivet for videnskab?
- Hvad er tidligere form for solnedgang?
- Kraftig hedebølge rammer genvindingen i Japan


