Hvad er lighederne mellem ædle gasser og alkalimetaller?
ædle gasser:
* Fuld ydre elektronskal: De har en stabil konfiguration med 8 valenselektroner (undtagen helium med 2).
* ureaktiv: De danner sjældent kemiske bindinger, fordi de ikke har nogen tendens til at vinde eller miste elektroner.
* Gasser ved stuetemperatur: De findes som monatomiske gasser.
alkalimetaller:
* en valenselektron: De har en enkelt elektron i deres ydre skal.
* Meget reaktiv: De mister let deres valenselektron for at danne kationer (+1 ladning) og danner let obligationer med ikke -metaller.
* bløde, sølvfarvede metaller: De er de mest reaktive metaller, og de er bløde nok til at blive skåret med en kniv.
Sammendrag af forskelle:
* reaktivitet: Noble gasser er ureaktive, mens alkalimetaller er meget reaktive.
* Elektronkonfiguration: Noble gasser har en fuld ydre skal, mens alkalimetaller har en valenselektron.
* Fysisk tilstand: Noble gasser er gasser ved stuetemperatur, mens alkalimetaller er faste stoffer.
* ionisk ladning: Noble gasser danner ikke ioner, mens alkalimetaller danner kationer.
Konklusion:
Mens ædle gasser og alkalimetaller begge er elementer, er de grundlæggende forskellige i deres kemiske opførsel og egenskaber på grund af deres forskellige elektronkonfigurationer. De er placeret på modsatte sider af den periodiske tabel og udviser kontrasterende reaktivitet og fysiske egenskaber.
Sidste artikelHvad er lighederne mellem et amorf og krystallinsk fast stof?
Næste artikelHvad er en lighed mellem metaller og salte?
 Varme artikler
Varme artikler
-
 Video:Hvordan slipper man af med den skunk lugt?Kredit:The American Chemical Society Skunks er natdyr, der foretrækker at holde sig for sig selv. Imidlertid, når de mærker fare, denne lurende leverandør af biokemisk krigsførelse frigiver sin p
Video:Hvordan slipper man af med den skunk lugt?Kredit:The American Chemical Society Skunks er natdyr, der foretrækker at holde sig for sig selv. Imidlertid, når de mærker fare, denne lurende leverandør af biokemisk krigsførelse frigiver sin p -
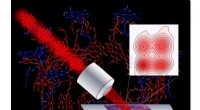 Forskere udvikler mikroskop til at spore lysenergistrøm i fotosyntetiske cellerAnvender en række ultrakorte laserpulser, et nyt mikroskop afslører indviklede detaljer, der styrer fotosyntetiske processer i lilla bakterier. Kredit:Vivek Tiwari, Yassel Acosta og Jennifer Ogilvie
Forskere udvikler mikroskop til at spore lysenergistrøm i fotosyntetiske cellerAnvender en række ultrakorte laserpulser, et nyt mikroskop afslører indviklede detaljer, der styrer fotosyntetiske processer i lilla bakterier. Kredit:Vivek Tiwari, Yassel Acosta og Jennifer Ogilvie -
 Gaslagringsmetode kan hjælpe næste generation af ren energikøretøjerMeget porøs programmerbar svamp til opbevaring af ren energi. Kredit:Northwestern University Et forskerhold ledet af Northwestern University har designet og syntetiseret nye materialer med ultrahø
Gaslagringsmetode kan hjælpe næste generation af ren energikøretøjerMeget porøs programmerbar svamp til opbevaring af ren energi. Kredit:Northwestern University Et forskerhold ledet af Northwestern University har designet og syntetiseret nye materialer med ultrahø -
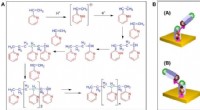 Oprettelse af en chiral polymer ud fra achirale monomerer ved hjælp af et magnetfeltSkematisk og en foreslået mekanisme for elektropolymerisationsprocessen af 2-vinylpyridin. (A) Skematisk over elektropolymerisationsprocessen af 2-vinylpyridin (25). (B) Skematisk af en foreslået
Oprettelse af en chiral polymer ud fra achirale monomerer ved hjælp af et magnetfeltSkematisk og en foreslået mekanisme for elektropolymerisationsprocessen af 2-vinylpyridin. (A) Skematisk over elektropolymerisationsprocessen af 2-vinylpyridin (25). (B) Skematisk af en foreslået
- Vi har brug for flere mennesker:Udmattede brandmænd kæmper mod Sibiriens flammer
- De lette kæde-underenheder af terapeutiske antistoffer påvirker lægemidlets ydeevne og udbytte
- Hvilke dyr spiser Gazeller?
- Fire årtiers data lyder tidlig advarsel på Lake George
- Finder du stabler buer og huler i Flamborough Head?
- Er tropiske skove modstandsdygtige over for global opvarmning?


