Hvorfor findes gruppe 1 og 7 elementer som forbindelser?
gruppe 1 (alkalimetaller)
* Høj reaktivitet: Alkalimetaller har kun en valenselektron, som de let mister for at opnå en stabil ædelgaskonfiguration. Dette gør dem meget reaktive.
* reaktion med ilt: De reagerer kraftigt med ilt i luften for at danne oxider, som er ioniske forbindelser. For eksempel reagerer natrium med ilt til dannelse af natriumoxid (Na₂O).
* reaktion med vand: De reagerer voldsomt med vand og producerer brintgas og en hydroxidopløsning. Denne reaktion er meget eksoterm. For eksempel reagerer lithium med vand til dannelse af lithiumhydroxid (LioH) og brintgas (H₂).
* reaktion med halogener: De reagerer let med halogener for at danne ioniske halogenider. For eksempel reagerer natrium med klor til dannelse af natriumchlorid (NaCI).
gruppe 7 (halogener)
* Høj elektronegativitet: Halogener har syv valenselektroner og er meget elektronegative, hvilket betyder, at de stærkt tiltrækker elektroner.
* reaktion med metaller: De reagerer med metaller for at danne ioniske halogenider. For eksempel reagerer klor med natrium til dannelse af natriumchlorid (NaCI).
* reaktion med ikke-metaler: De kan også reagere med andre ikke-metaler for at danne kovalente forbindelser. For eksempel reagerer klor med brint til dannelse af brintchlorid (HCI).
* diatomiske molekyler: Halogener findes som diatomiske molekyler (f.eks. Cl₂, br₂, i₂) på grund af deres tendens til at dele elektroner og opnå en stabil oktet.
Kortfattet:
Den høje reaktivitet i gruppe 1 og gruppe 7 -elementer fører dem til let at danne forbindelser med andre elementer. Denne reaktivitet er drevet af deres ønske om at opnå en stabil elektronkonfiguration, enten ved at miste elektroner (alkalimetaller) eller få elektroner (halogener).
 Varme artikler
Varme artikler
-
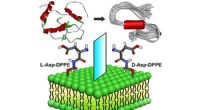 Nye fund kaster lys over udviklingen af liposom-baserede hæmmereMolekylær chiralitet medieret amyloiddannelse på phospholipidoverflader. Kredit:WANG Xue Alzheimers sygdom (AD) er en af de største globale folkesundhedsudfordringer. Imidlertid, patogenesen af
Nye fund kaster lys over udviklingen af liposom-baserede hæmmereMolekylær chiralitet medieret amyloiddannelse på phospholipidoverflader. Kredit:WANG Xue Alzheimers sygdom (AD) er en af de største globale folkesundhedsudfordringer. Imidlertid, patogenesen af -
 Forskere finder, at simpelt kobberkompleks lukker ned for botulinum-neurotoksinforgiftningClostridium botulinum-bakterien (vist her i kolonier) kan forårsage fødevarebårne sygdomme og potentielt dødelige virkninger på grund af det neurotoksin, den producerer. Kredit:CDC Botulinum neuro
Forskere finder, at simpelt kobberkompleks lukker ned for botulinum-neurotoksinforgiftningClostridium botulinum-bakterien (vist her i kolonier) kan forårsage fødevarebårne sygdomme og potentielt dødelige virkninger på grund af det neurotoksin, den producerer. Kredit:CDC Botulinum neuro -
 Danner den ion, der skabte universettrihydrogenkationen, H 3+ , spiller en stor rolle i interstellar kemi, hvor det letter dannelsen af vand og organiske molekyler. Forskere har opdaget, hvordan kationen dannes, når organiske moleky
Danner den ion, der skabte universettrihydrogenkationen, H 3+ , spiller en stor rolle i interstellar kemi, hvor det letter dannelsen af vand og organiske molekyler. Forskere har opdaget, hvordan kationen dannes, når organiske moleky -
 Astronauter udfører metallurgiske eksperimenter ombord på ISSDette billede viser, hvordan en metallegering kunne se ud, når den størkner, ved at bruge en gennemsigtig organisk blanding som stand-in for metaller. Røntgenstråler giver os mulighed for at kigge ind
Astronauter udfører metallurgiske eksperimenter ombord på ISSDette billede viser, hvordan en metallegering kunne se ud, når den størkner, ved at bruge en gennemsigtig organisk blanding som stand-in for metaller. Røntgenstråler giver os mulighed for at kigge ind
- Revurderer strategier for at reducere fosforindholdet i Detroit -flodens vandområde
- CERNs seneste LS2-rapport:Beams cirkulerer i PS Booster
- Forfinende fremskrivninger af Antarktis istab og global havniveaustigning
- Grønne ørepropper
- Forhindrer dødbringende hjerteblokeringer med organiske nanopartikler
- Oprør i Tyrkiet over at fjerne evolution fra biologitimerne


