Hvad sker der med smeltepunktet for alkalimetaller, når atomet stiger i størrelse?
* Metallisk binding: Alkalimetaller holdes sammen ved metallisk binding, som involverer delokalisering af elektroner.
* Elektrondensitet: Efterhånden som atomstørrelsen øges, er valenselektronerne længere væk fra kernen. Dette betyder, at elektrondensiteten i den metalliske binding falder.
* svagere attraktion: En lavere elektrondensitet fører til svagere elektrostatiske attraktioner mellem de positivt ladede metalioner og de delokaliserede elektroner.
* lavere smeltepunkt: Svagere attraktioner betyder, at der kræves mindre energi for at bryde bindingerne og smelte metallet. Derfor har større alkalimetaller lavere smeltepunkter.
Eksempel:
* Lithium (Li) har den mindste atomradius og det højeste smeltepunkt (180,5 ° C).
* Cesium (CS) har den største atomradius og det laveste smeltepunkt (28,4 ° C).
Denne tendens er konsistent på tværs af hele alkali -metalgruppen.
Sidste artikelEr en nedbrydningsreaktion næsten den samme som synteseaktion?
Næste artikelHvilken slags recation er 2KCLO3 2KCL 3O2?
 Varme artikler
Varme artikler
-
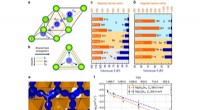 Hellig gral til batterier:Solid-state magnesiumbatteri et stort skridt tættere påFørste principper Mg og Zn migrationsbarrierer i sulfider, selenider, og tellurides AX2Z4 spineller (med A =Mg eller Zn). en tet -okt -tet -migrationssti i AX2Z4 -rammen, med tetets energi, okt. og ov
Hellig gral til batterier:Solid-state magnesiumbatteri et stort skridt tættere påFørste principper Mg og Zn migrationsbarrierer i sulfider, selenider, og tellurides AX2Z4 spineller (med A =Mg eller Zn). en tet -okt -tet -migrationssti i AX2Z4 -rammen, med tetets energi, okt. og ov -
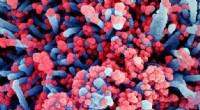 Forstå overfladekemien af SARS-CoV-2Farvelagt scanningselektronmikrofotografi af en celle (blå) stærkt inficeret med SARS-CoV-2-viruspartikler (rød), isoleret fra en patientprøve. Billede taget på NIAID Integrated Research Facility (IRF
Forstå overfladekemien af SARS-CoV-2Farvelagt scanningselektronmikrofotografi af en celle (blå) stærkt inficeret med SARS-CoV-2-viruspartikler (rød), isoleret fra en patientprøve. Billede taget på NIAID Integrated Research Facility (IRF -
 3-D katalysatorer til forbedrede hydrazinfrie drivmidlerKredit:RHEFORM Hydrazin, et af de mest udbredte flydende drivmidler til rumfremdrivningssystemer, er også ekstremt giftig. EU-forskere har udviklet 3D-katalysatorer til antændelse af alternative d
3-D katalysatorer til forbedrede hydrazinfrie drivmidlerKredit:RHEFORM Hydrazin, et af de mest udbredte flydende drivmidler til rumfremdrivningssystemer, er også ekstremt giftig. EU-forskere har udviklet 3D-katalysatorer til antændelse af alternative d -
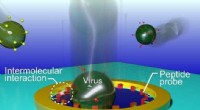 Ny viral identifikationsmetode udvikletFig. Enkeltvirus-detektioner ved ioniske strømmålinger i en peptid-dekoreret Au nanopore. Kredit:Osaka University I øjeblikket, influenzatypning i klinisk praksis udføres ved anvendelse af en immu
Ny viral identifikationsmetode udvikletFig. Enkeltvirus-detektioner ved ioniske strømmålinger i en peptid-dekoreret Au nanopore. Kredit:Osaka University I øjeblikket, influenzatypning i klinisk praksis udføres ved anvendelse af en immu


