Er en nedbrydningsreaktion næsten den samme som synteseaktion?
Her er sammenbruddet:
Nedbrydningsreaktion:
* Definition: En enkelt reaktant opdeles i to eller flere produkter.
* Generel form: AB → A + B
* Eksempel: Nedbrydningen af vand til brint og ilt:2H₂O → 2H₂ + O₂
Synteseaktion:
* Definition: To eller flere reaktanter kombineres for at danne et enkelt produkt.
* Generel form: A + B → AB
* Eksempel: Syntesen af vand fra brint og ilt:2H₂ + O₂ → 2H₂O
Nøgleforskelle:
* reaktanter og produkter: Nedbrydningsreaktioner starter med en reaktant og slutter med flere produkter, mens synteseaktioner starter med flere reaktanter og slutter med et produkt.
* Energiændring: Nedbrydningsreaktioner kræver typisk energiindgang (endotermisk), mens synteseaktioner ofte frigiver energi (eksoterm).
Sammenfattende er nedbrydning det modsatte af syntese. De er ikke de samme, men snarere to modsatte typer kemiske reaktioner.
 Varme artikler
Varme artikler
-
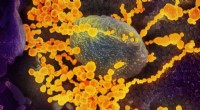 Forskere viser, at selvsteriliserende polymerer virker mod SARS-CoV-2Dette scanningselektronmikroskopbillede viser SARS-CoV-2 (runde guldobjekter), der dukker op fra overfladen af celler dyrket i laboratoriet. Kredit:NIAID-RML Forskere fra North Carolina State Un
Forskere viser, at selvsteriliserende polymerer virker mod SARS-CoV-2Dette scanningselektronmikroskopbillede viser SARS-CoV-2 (runde guldobjekter), der dukker op fra overfladen af celler dyrket i laboratoriet. Kredit:NIAID-RML Forskere fra North Carolina State Un -
 Dens elementære:Ultra-spordetektor tester guldrenhedKhadouja Harouaka (siddende) og Isaac Arnquist forbereder prøver i et ultrarent laboratorium, hvilket er nødvendigt for at sikre nøjagtige massespektrometrimålinger. Kredit:Andrea Starr | Pacific Nort
Dens elementære:Ultra-spordetektor tester guldrenhedKhadouja Harouaka (siddende) og Isaac Arnquist forbereder prøver i et ultrarent laboratorium, hvilket er nødvendigt for at sikre nøjagtige massespektrometrimålinger. Kredit:Andrea Starr | Pacific Nort -
 Ny teknologi til at opdage bitre mandler i realtidNIRS -sensoren, der bruges af forskergruppen. Kredit:University of Córdoba Hvem har ikke på et tidspunkt tygget på en mandel og smagt en ubehagelig og uventet eftersmag, der ikke har noget at gøre
Ny teknologi til at opdage bitre mandler i realtidNIRS -sensoren, der bruges af forskergruppen. Kredit:University of Córdoba Hvem har ikke på et tidspunkt tygget på en mandel og smagt en ubehagelig og uventet eftersmag, der ikke har noget at gøre -
 Kontinuerlig og stabil lasning opnået fra billige perovskitter ved stuetemperaturEt lag perovskit vises lasende grønt under kontinuerlig drift ved stuetemperatur. Forskning fra Kyushu University og Changchun Institute of Applied Chemistry, Det Kinesiske Videnskabsakademi, indikere
Kontinuerlig og stabil lasning opnået fra billige perovskitter ved stuetemperaturEt lag perovskit vises lasende grønt under kontinuerlig drift ved stuetemperatur. Forskning fra Kyushu University og Changchun Institute of Applied Chemistry, Det Kinesiske Videnskabsakademi, indikere
- Første in-situ temperaturmåling af de termofysiske egenskaber af månens fjernside regolith
- Brug af polymerer til at kontrollere nanopartiklers organisatoriske adfærd
- Undersøgelse af dynamikken i demokratiske valg ved hjælp af fysikkteori
- England bagud for andre lande i matematikpræstationer for dårligt stillede elever
- Hvorfor lever celle indeholder chloroplast?
- Forskere opnår direkte kontrafaktisk kvantekommunikation


