Hvad har to valenselektroner og kommer til en stabil elektronkonfiguration ved at miste elektroner?
Her er hvorfor:
* Valenselektroner: Alkaliske jordmetaller har to elektroner i deres yderste skal (Valence Shell).
* stabil konfiguration: De får en stabil elektronkonfiguration ved at miste disse to valenselektroner. Dette efterlader dem med en fuld ydre skal, der efterligner den stabile konfiguration af den ædle gas forud for dem i den periodiske tabel.
* ioner: Efter at have mistet elektroner bliver alkaliske jordmetaller positivt ladede ioner (kationer) med en +2 ladning.
Eksempler på alkaliske jordmetaller:
* Beryllium (BE)
* Magnesium (mg)
* Calcium (CA)
* Strontium (SR)
* Barium (BA)
* Radium (RA)
Sidste artikelSlår et matchkemisk eller fysisk?
Næste artikelHvad er den enkelte udskiftningsreaktion for CA plus H2O?
 Varme artikler
Varme artikler
-
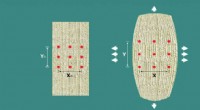 2D-materialer tilbyder unikke strækegenskaberAuxetiske materialer bliver tykkere, når de strækkes og tyndere, når de komprimeres. Det auxetiske materiale til venstre vokser i bredden, når det trækkes i lodret retning, som vist til højre. Kredit:
2D-materialer tilbyder unikke strækegenskaberAuxetiske materialer bliver tykkere, når de strækkes og tyndere, når de komprimeres. Det auxetiske materiale til venstre vokser i bredden, når det trækkes i lodret retning, som vist til højre. Kredit: -
 Forskere efterligner neuralt vævNyt banebrydende materiale kan føre til fremtidig autonom blød robotteknologi, dobbelte sensorer og aktuatorer til bløde eksoskeletter, eller kunstigt skind. Kredit:U.S. Army Research Laboratory U
Forskere efterligner neuralt vævNyt banebrydende materiale kan føre til fremtidig autonom blød robotteknologi, dobbelte sensorer og aktuatorer til bløde eksoskeletter, eller kunstigt skind. Kredit:U.S. Army Research Laboratory U -
 Gør smørlignende smørepålæg sundereForskere erstatter mættet fedt med solsikke, risklid, candelilla og andre naturlige vokstyper for at skabe sundere margariner og smørepålæg til forbrugerne. Kredit:Functional Foods Research Unit En
Gør smørlignende smørepålæg sundereForskere erstatter mættet fedt med solsikke, risklid, candelilla og andre naturlige vokstyper for at skabe sundere margariner og smørepålæg til forbrugerne. Kredit:Functional Foods Research Unit En -
 Ny proces gør bionedbrydeligt plastik virkelig komposterbartEn modificeret plast (til venstre) nedbrydes efter kun tre dage i standardkompost (højre) og helt efter to uger. Kredit:Christopher DelRe, UC Berkeley Bionedbrydeligt plast er blevet annonceret so
Ny proces gør bionedbrydeligt plastik virkelig komposterbartEn modificeret plast (til venstre) nedbrydes efter kun tre dage i standardkompost (højre) og helt efter to uger. Kredit:Christopher DelRe, UC Berkeley Bionedbrydeligt plast er blevet annonceret so
- Kornvidenskabsprojekter
- Hvad hedder de mandlige og kvindelige gameter, hvad er resultatet af deres fusion?
- Hvad er to energikilder til jordsytemet?
- Det tidligere atomvåbenanlæg i Colorado åbner for offentligheden som tilflugtssted for vilde dyr
- Sådan beregnes genoprettede længder
- Hvilken slags jord har Ouachita -bjergene?


