Hvorfor danner gruppe 4 -metaller ioner?
* Elektronkonfiguration: Gruppe 4 metaller har 4 valenselektroner (elektroner i den yderste skal). Dette betyder, at de er relativt tæt på at have en fuld ydre skal, hvilket er en stabil konfiguration.
* ioniseringsenergi: Disse metaller har relativt lave ioniseringsenergier, hvilket betyder, at det ikke kræver meget energi for at fjerne elektroner fra deres ydre skaller.
* Elektropositivitet: Gruppe 4 -metaller er elektropositive, hvilket betyder, at de har en tendens til at miste elektroner og blive kationer (positivt ladede ioner).
hvordan de danner ioner:
1. Tab af elektroner: For at opnå en stabil elektronkonfiguration mister gruppe 4 metaller typisk deres 4 valenselektroner. Dette efterlader dem med en +4 ladning, danner ioner som Ti⁴⁺, Zr⁴⁺ og HF⁴⁺.
2. Dannelse af ioniske bindinger: Disse positivt ladede ioner danner derefter let ioniske bindinger med negativt ladede ikke -metaller, såsom ilt (O²⁻) eller chlor (CL⁻), hvilket skaber forbindelser som titandioxid (TiO₂) eller zirkoniumchlorid (ZRCL₄).
Vigtige noter:
* Variabel oxidation siger: Mens +4 oxidationstilstand er mest almindelig, kan gruppe 4 -metaller også udvise andre oxidationstilstande, som +2 og +3, i visse forbindelser.
* reaktivitet: Reaktiviteten af gruppe 4 -metaller øges ned i gruppen. Titanium er relativt reaktiv, mens zirconium og hafnium er mindre reaktive.
* applikationer: Gruppe 4 metaller og deres forbindelser har forskellige anvendelser på grund af deres unikke egenskaber, herunder høje smeltepunkter, styrke og modstand mod korrosion. Eksempler inkluderer anvendelse i rumfart, medicinske implantater og pigmenter.
I sammendraget er tendensen til at opnå en stabil elektronkonfiguration, lav ioniseringsenergi og elektropositiv naturdrevgruppe 4 metaller for at miste elektroner og danne ioner. Dette fører til dannelsen af ioniske bindinger og en lang række forbindelser med værdifulde anvendelser.
Sidste artikelHvorfor er metan eksoterm?
Næste artikelHvor finder du tipisk anioner på den periodiske tabel?
 Varme artikler
Varme artikler
-
 Forskerhold øger klæbeevnen af silikone ved at bruge eksemplet med billerForskellige konfigurationer ændrer den klæbende effekt af silikonematerialet, hvis overflade har fået en svampelignende struktur. Vedhæftningen er bedst, når den er bøjet konkav (højre). Kredit:© Emre
Forskerhold øger klæbeevnen af silikone ved at bruge eksemplet med billerForskellige konfigurationer ændrer den klæbende effekt af silikonematerialet, hvis overflade har fået en svampelignende struktur. Vedhæftningen er bedst, når den er bøjet konkav (højre). Kredit:© Emre -
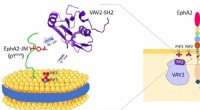 Forskere afslører dobbelt specificitet af Vav2-SH2-proteinVav2-protein binder til cellemembranfosfolipider og receptortyrosinkinase EphA2 juxtamembranregionen. Kredit:HFIPS For nylig, et forskerhold ledet af prof. Wang Junfeng fra High Magnetic Field Lab
Forskere afslører dobbelt specificitet af Vav2-SH2-proteinVav2-protein binder til cellemembranfosfolipider og receptortyrosinkinase EphA2 juxtamembranregionen. Kredit:HFIPS For nylig, et forskerhold ledet af prof. Wang Junfeng fra High Magnetic Field Lab -
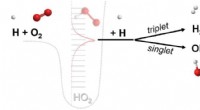 Forskere opdager en ny klasse af kemisk reaktionEn kemisk reaktion, hvor tre forskellige molekyler (fx H, O2, H) hver deltager i brydning og dannelse af kemiske bindinger. Reaktionen medieres af et flygtig kollisionskompleks (HO2**) dannet ved samm
Forskere opdager en ny klasse af kemisk reaktionEn kemisk reaktion, hvor tre forskellige molekyler (fx H, O2, H) hver deltager i brydning og dannelse af kemiske bindinger. Reaktionen medieres af et flygtig kollisionskompleks (HO2**) dannet ved samm -
 Ny tilgang til maskinlæring er bedre til at se enzymatiske metaller i proteinerJoanna Slusky, lektor i molekylær biovidenskab og beregningsbiologi ved University of Kansas, leder laboratoriet, hvor maskinlæring forbedrede præcisionen ved at identificere enzymatiske og ikke-enzym
Ny tilgang til maskinlæring er bedre til at se enzymatiske metaller i proteinerJoanna Slusky, lektor i molekylær biovidenskab og beregningsbiologi ved University of Kansas, leder laboratoriet, hvor maskinlæring forbedrede præcisionen ved at identificere enzymatiske og ikke-enzym
- Astronomer udfører en omfattende undersøgelse af den unge åbne klynge NGC 1960
- Hvorfor er de lettere farvede halvdele af måne og jord altid mod solen?
- Med hvilke to former for solenergi er du mest kendt?
- Er entomologien Sceince of Human Cultures?
- Et nyt spin på livets oprindelse?
- De berømte oliventræer i Puglia er hærget af sygdom – her er hvordan vi kan redde dem


